Chirurgia della Mammella (2/4)
- Dettagli
- Categoria: Lezioni
- Pubblicato Domenica, 10 Agosto 2014 21:46
- Scritto da Paolo Purri
- Visite: 8543
  INTRODUZIONE Affrontando il problema della patologia neoplastica maligna della mammella si è subito sorpresi dalle caratteristiche di lunga durata della malattia e di marcata eterogeneità tra pazienti diverse e nell'ambito delle stesse pazienti. Colpisce, ad esempio, l'esistenza di tumori con una lenta crescita e - di conseguenza - con un periodo pre-clinico ed una fase clinica (dall'esordio del trattamento e la comparsa di metastasi) spesso di anni o addirittura decadi; a fronte di forme molto aggressive che modellano un decorso assai breve e rapidamente letale. Spesso ci si imbatte in casi in cui la lesione mostra un andamento così indolente da mettere in discussione l'effettiva icidenza del trattamento sulla sopravvivenza riscontrata; ciò si spiega con una ampia opportunità di mutazioni ed evoluzioni clonali nell'ambito della lunga fase clinica, così che si può accettare che quasi tutte le neoplasie mammarie presentino multipli cloni neoplastici, ciascuno dei quali con proprie esigenze, modalità e velocità di crescita, proprie propensioni alla metastatizzazione e sensibilità ai farmaci. Per tutto quanto appena esposto il capitolo della patologia maligna della mmammella si dimostra quanto mai complesso e non può prescindere da una serie di parametri valutativi essenziali sia per il percorso della prevenzione che per quello del più efficace e corretto trattamento terapeutico.  EPIDEMIOLOGIA (Diapositive 2-5) Dal punto di vista della morbilità e della mortalità il cancro è di gran lunga il problema maggiore per la mammella, riservando alle patologie benigne attenzioni dettate unicamente dalle non infrequenti difficoltà di diagnostica differenziale con le lesioni maligne. Per questo motivo negli ultimi anni sono stati definiti quattro capisaldi per la risoluzione di tutte le controversie, come riportato nella diapositiva 2. Proprio per il fatto di rappresentare la forma neoplastica più frequente nei soggetti di sesso femminile (oltre il 5%), con ancora più elevata rappresentazione tra tutte le donne colpite da una qualsivoglia forma neoplastica (olre il 25%), il cancro della mammella ha concentrato l'attenzione di studi e ricerche specifiche in tutto il mondo, con riferimento all'incidenza, allo sviluppo, al decorso clinico, alla aggressività biologica, alle modalità di diffusione ed alla sopravvivenza. Pur essendo ancora sconosciute le cause di insorgenza di una neoplasia mammaria, nella valutazione di ipotetici fattori di rischio non si può sottacere il valore di certi riscontri nella storia familiare, specie per la presenza di casi di iperplasia mammaria o di neoplasie franche nei parenti di primo grado; mentre assai più significativa è la relazione tra incidenza neoplastica e ciclo fisiologico (menarca precoce e menopausa tardiva). Ugualmente non privo di valore è il riscontro di una gravidanza tardiva o l'assoluta assenza di gravidanze nell'ambito di più ampie valutazioni che contemplano l'influenza estrinica esogena (come per assunzioni nel periodo post-menopausale o per l'impiego di contraccettivi in età precoce). Da molti è anche chiamato in causa l'effetto di alcolici,l'assorbimento radiogeno (a scopo terapeutico e non) ed irregolarità dietetiche. In particolare, nella valutazione del rischio neoplastico si tende a concentrare l'attenzione su tre cardini fondamentali : fattori endocrini, fattori ambientali e comportamentali e fattori genetici.  |
 |
02.  |
|
|
 04.  |
 |
05.  FATTORI DI RISCHIO (diapositive 6-12) Il cancro della mammella è pressochè sconosciuto in età pre-puberale ed è molto raro prima dei venti anni: questo riscontro dimostra il ruolo dell'età nella cancerogenesi mammaria femminile. Con il progredire dell'età progredisce con andamento lineare il rischio neoplastico fino a stabilizzarsi intorno ai 45-55 anni, periodo in cui si registra una sorta di acquiescenza, forse in relazione con il periodo della menopausa in cui si verifica una sostanziale modifica del patrimonio ormonale specifico; rischio che successivamente torna a crescere con andamento lineare fino alla tarda età (intorno alla ottava decade di vita) in cui risulta quasi raddoppiato rispetto alla sesta decade. L'età, peraltro, assume particolare valore in riferimento alla positività nella storia familiare; infatti in questi casi i soggetti colpiti risultano giovani e frequentemente presentano bilateralità di impegno neoplastico. Nient'affatto trascurabile è l'interrelazione tra l'epoca di insorgenza del menarca ed il rischio di cancro mammario (diapositiva 6), così come quella tra epoca della menopausa e rischio di carcinogenesi (diapositiva 7). Sebbene vi sia una relazione diretta con la durata del ciclo mestruale, maggiore importanza assume l'intervallo tra il menarca e la prima gravidanza (diapositiva 8), con chiara evidenza di più alto rischio nelle nullipare, nelle quali il livello di prolattina è nettamente superiore a quello delle pluripare; ciò fa ipotizzare che alti livelli di estrogeni e di prolattina possano favorire l'insorgenza del cancro, mentre un ruolo inibitorio è ascritto al progesterone, sia pure con meccanismo non ben definito. L'uso degli estrogeni nella terapia sostitutiva in periodo di menopausa o l'impiego dei contraccettivi orali possono comportare un leggero incremento del rischio di cancro mammario, molto inferiore a quello di insorgenza del cancro dell'endometrio; il rischio - quasi nullo per assunzioni a basso dosaggio - si incrementa notevolmente per accumulo di dosi massicce, specie in soggetti già sottoposti ad ovariectomia o pertatrici di una patologia benigna mammaria (diapositiva 9). Particolare attenzione va comunque rivolta all'assunzione di contraccettivi, con riferimento alla dose giornaliera ed al tempo di utilizzo complessivo. La possibilità che fattori ambientali incidano sul rischio di cancerogenesi mammaria è documentata dall'osservazione di un incremento di questa neoplasia in popolazioni migrate da aree a bassa incidenza (ad esempio Giappone) verso aree a maggiore incidenza (ad esempio Stati Uniti d'America); il tutto confermato da una pari incidenza nei figli degli immigrati ed i nati in territorio americano. Lo stesso vale per alcuni componenti della dieta, con una possibile relazione - non confortata da risultati certi - tra l'assunzione di grassi e colesterolo e la più alta incidenza di cancro mammario, probabilmente per incremento del metabolismo steroideo nel periodo post-menopausa. Similmente il supposto rapporto di interrelazione tra l'assunzione di alcolici ed il cancro non ha trovato assolute conferme, se non nel fatto che una assunzione sia pur moderata ma continuata nel tempo espone ad un incremento del rischio nell'ordine del 50% circa rispetto ai soggetti non bevitori. Anche se non è provata una trasmissione genetica della neoplasia nei discendenti di una stessa famiglia, è inequivocabile un incremento del rischio neoplastico nei familiari di primo grado, con indice decalante nei gradi successivi di parentela; in particolare il rischio risulta più elevato nei familiari di donne affette da neoplasia bilaterale. Esiste, inoltre, una provata relazione tra cancro mammario ed esposizione ad irradiazione: ricerche eseguite con tale intendimento, condotte su popolazioni di aree soggette a bombardamenti bellici o su pazienti sottoposte ad esposizioni terapeutiche o diagnostiche ripetute e prolungate, hanno portato al riconoscimento di un incremento del rischio dopo una latenza temporale media di 10-15 anni, con incidenze pressochè invalutabili per esposizioni oltre i 40 anni di età. L'insorgenza del cancro in portatrici di malattia fibrocistica della mammella è relativamente infrequente (< 3%), a dispetto di una significativa incidenza di questa patologia benigna; la ragione di ciò sta nel fatto che spesso una mammella granulosa (lumpy breast) viene confusa con una espressione fibrocistica propriamente detta. Il rischio di cancro - del tipo invasivo - cresce invece fino a quattro volte in presenza di iperplasia atipica, ed ancor più se questa è associata con una storia familiare positiva per neoplasia ghiandolare. Un dato di principio è comunque che le lesioni mammarie benigne non rappresentano - se non raramente - una indicazione ad un attento monitoraggio e mai sono indicative della necessità di una ablazione chirurgica con finalità preventiva.  |
 06.  |
 |
07.  |
 08.  |
 |
09.  |
 |
10.  |
 |
11.  |
 12.  STORIA NATURALE E INDICI PREDITTIVI (diapositive 13-16) La storia naturale del cancro mammario è caratterizzata da una lunga durata ed una marcata eterogeneità; è cioè un tumore a lenta crescita, con una fase pre-clinica ed una fase clinica a volte di anni se non di decadi. L'eterogeneità è documentata dall'esistenza di forme particolarmente aggressive a fianco di altre che per un decorso segnatamente lento rendono difficile attribuire alla sola efficacia della terapia un risultato di lunga sopravvivenza. Durante la lunga fase clinica è possibile un'ampia opportunità di mutazioni clonali, così che risulti più che probabile che pazienti affette dal cancro mammario ospitino cloni tumorali multipli, ciascuno con proprie caratteristiche di crescita e propensione a dare metastasi, nonchè diversa responsività ai farmaci; oltre a casi di lunga sopravvivenza in assenza di qualsivoglia trattamento. Per questi motivi le indicazioni chirurgiche sono molto cambiate negli anni, specie alla luce dell'evidenza che una mastectomia radicale non necessariamente fornisce risultati in termini di curabilità e sopravvivenza superiori a trattamenti exeretici più conservativi (come una quadrantectomia). Nelle forme a sviluppo lento (60% circa dei casi) il più elevato indice di mortalità si registra nella prima decade successiva alla diagnosi, con un valore medio pari al 2,5% all'anno ed una grossolana stabilizzazione nella decade successiva di follow-up; in quelle ad andamento decisamente più aggressivo (restante 40%) si registra una mortalità del 25% annuo a scalare, così che il ciclo di vita si completa nell'ambito della prima decade successiva al trattamento chirurgico messo in atto. Si introduce così il concetto del "labelling index" della neoplasia, una misura dell'attività mitotica celluleare, definito come il numero di cellule nella fase S del ciclo di crescita diviso per la totalità delle cellule della popolazione neoplastica; cioè la misura percentuale di cellule tumorali che subiscono una suddivisione in un determinato tempo durante lo sviluppo della neoplasia: pazienti con un indice al disotto del 4 % (circa il 60% dei casi) mostrano una più lenta crescita del tumore rispetto a pazienti con un indice compreso tra 4% e 40% (circa 40% dei casi) che mostrano una crescita tumorale più rapida.  |
 |
13.  |
 14.  |
 |
15.  |
 |
16.  IL PERCORSO PRE-CLINICO (diapositive 17-19) Nella valutazione degli eventi pre-clinici c'è da tenere conto dell'indice mitotico, del tempo di raddoppio della massa neoplastica e della frazione di crescita della neoplasia; in relazione a questi parametri un carcinoma mammario che si presenti voluminoso all'identificazione in fase clinica dimostra un indice di crescita più basso delle corrispettive lesioni microscopiche in fase pre-clinica. In ragione di ciò si può affermare che le neoplasie maligne mammarie presentano mediamente un più basso "labelling index" rispetto ad altri tumori (come i linfomi), più lungo "doubling time" rispetto ai tumori embrionari e più basso indice di crescita rispetto ad entrambi quelli citati. Il tempo di raddoppio del carcinoma mammario nelle sue fasi di esordio clinico (fase clinica precoce) viene determinato mediante la misura della lesione presente ma non riconosciuta già come cancro all'indagine mammografica; nelle esperienze più vaste ed accreditate esso varia moltissimo, con un "range" compreso tra 30 giorni e tre anni circa. La crescita in fase pre-clinica è logaritmica e continua; considerando che una lesione palpabile misura circa un centimetro di diametro e contiene mediamente dieci miliardi di cellule, e partendo dal presupposto che la neoplasia origina da una singola cellula maligna, necessiterebbero 30 raddoppi per raggiungere il numero di cellule componenti la lesione di un centimetro di diametro (assunto che non si verifichino distruzuioni cellulari negli intervalli di tempo). Su questa base di calcolo si comprende l'assunto della lunga latenza clinica delle neoplasie maligne mammarie, anche in considerazione di differenti indici di accrescimento tra tumori diversi e tra pazienti diverse. All'atto pratico appare più verosimile riconoscere, nella valutazione della latenza clinica, la possibilità di alternanza di periodi di crescita logaritmica con periodi di quiescenza o di rallentata crescita, anche alla luce di possibili asincronie nella crescita di siti metastatici diversi. Quanto detto non è certamente fine a se stesso, bensì si inquadra nel grosso capitolo del comportamento delle neoplasie mammarie in riferimento al grado di differenziazione istologica, delle modalità di diffusione, della capacità di impegno linfoghiandolare regionale ed a distanza. Proprio a tale proposito si è constatata la sovrapponibile sopravvivenza a cinque anni dal trattamento di neoplasie esenti da interessamento linfonodale ed altre con un solo linfonodo già coinvolto nel processo patologico; con una netta divergenza delle curve di sopravvivenza se il follow-up viene protratto a dieci anni ed oltre. Questo introduce il discorso su altre caratteristiche specifiche delle neoplasie mammarie, la cui conoscenza offre diverse opportunità terapeutiche e prospettive di vita residua.  |
 |
17.  |
 |
18.  |
 |
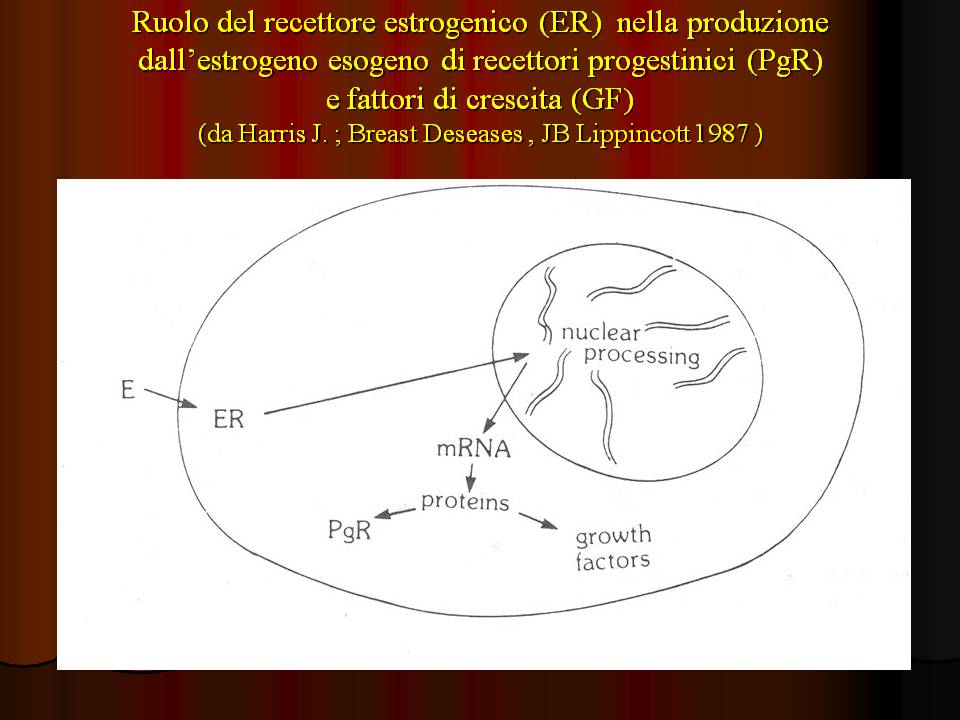
19.  RECETTORI ORMONALI E PROFILO PROGNOSTICO (diapositive 20-29) E' noto ormai da tempo che solo una parte delle neoplasie mammarie risponde alla terapia ormonale; tali neoplasie caratterizzano una forma più "indolente" di malattia. L'identificazione delle forme ormono-sensibili è affidata al riconoscimento dell'esistenza nel tumore di recettori ormonali, estrinici, progestinici o estro-progestinici; ciò si ottiene realizzando un profilo endocrino mediante l'interazione di omogenati tissutali (contenenti i recettori eventualmente presenti) con estrogeno contrassegnato con radioisotopo; o utilizzando anticorpi monoclonali per il metodo immunochimico (ERICA) o quello immunoradiometrico (IRMA). Il grande vantaggio di questi ultimi sta nella capacità di dimostrare l'eterogeneità della cellula tumorale e di stimare meglio la massima quota di cellule neoplastiche suscettibili di distruzione con la terapia ormonale. La positività recettoriale estrinica si registra in circa 2/3 dei casi, con responsività al trattamento ormonale in almeno la metà di questa quota. Le neoplasie insorte in età avanzata o in periodo post-menopausa più facilmente presentano recettori positivi rispetto a soggetti giovani o in età fertile. E' importante, tuttavia, considerare che l'incidenza di positività si riduce nel tempo, così che assume più alta predittività la misura effettuata in stretta vicinanza con l'inizio di qualsivoglia trattamento mirato. Tale tipo di informazione risulta di grande significato prognostico, oltre ad influenzare in modo determinante la scelta di terapie complementari e concorrere alla selezione di procedure palliative in caso di malattia metastatica con difficoltà di accesso alla sede della metastasi. Per spiegare le regioni per le quali non tutti i tumori recettori-positivi rispondono in ugual misura alla terapia ormonale bisogna ammettere che nell'ambito di una neoplasia coesistano due componenti cellulari recettori-positive: una in grado di determinare la positività dei tests e l'altra insufficiente a determinare una effettiva riduzione della massa tumorale per necrosi sotto l'azione dell'anti-ormone somministrato. Quando le cellule neoplastiche con recettori etrinici intatti e funzionanti sono esposte all'estrogeno esogeno questo viene trasportato nel nucleo dove si forma l'RNA-messaggero (diapositiva 24); da questa interazione derivano recettori progestinici e fattori di crescita, oltre ad ulteriore recettore estrogenico. Ne consegue che recettori PgR sono marcatori di recettori ER intatti e che neoplasie con entrambi i tipi di recettori si dimostrano più responsive alla terapia ormonale di quelle con soli recettori estrogenici; vi sono, cioè, cellule ER e/o PgR inattive che limitano la responsività del tumore in toto alla terapia ormonale. L'indagine che mira alla ricerca della positività recettoriale delle cellule neoplastiche non è dunque fine a se stessa ma ha obiettivi ben precisi e di assoluta utilità: fra questi occupa un ruolo di primario valore l'impiego per la definizione del profilo prognostico della neoplasia. Si sa, infatti, che pazienti con responsività alla terapia ormonale dimostrano un più lungo intervallo libero da malattia, e che quelli con positività ad entrambi i recettori ormonali aggiungono a questa caratteristica anche quella di fornire una più lunga sopravvivenza dopo la comparsa di focolai metastatici rispetto a soggetti con neoplasie recettori-negativi. Dunque si può affermare che lo "status recettoriale" delle neoplasie mammarie riflette la crescita propria del tumore; così che neoplasie con positività recettoriale prospettano una migliore prognosi ed una maggiore sopravvivenza a breve termine. Lo stesso non sembra potersi riconoscere quanto a possibilità di ripresa di malattia dopo il trattamento, che invece si presenta del tutto sovrapponibile tra le due classi di neoplasie. Qui l'elemento più marcatamente differenziativo è legato alla negatività linfonodale all'intervento, con indici di sopravvivenza a 5 e 10 anni nettamente migliori, nonostante una percentuale di recidive tra il 15% ed il 30% ma con una possibilità terapeutica complementare in più data dalla responsività al trattamento con anti-ormoni.  |
 20.  |
 21.  |
 22.  |
 23.  |
 24.  |
 25.  |
 26.  |
 27.  |
 28.  |
 29.  |
BIBLIOGRAFIA
Agboola A.O., Banjo A.A., Anunobi C.C., Ayoade B.A., Deji-Agboola A.M., Musa A.A., Abdel-Fatah T., Nolan C.C, Rakha E.A., Ellis I.O., Green A.R. : Molecular profiling of breast cancer in Nigerian women identifies an altered p53 pathway as a major mechanism underlying its poor prognosis compared with British counterpart. Malays J. Pathol. 2014; Apr. 36(1), 3-17.
Armstrong A.C., Evans G.D. : Management of women at high risk of breast cancer. BMJ. 2014; Apr. 28, 348
Ashton-Prolla P., Vargas F.R. : Prevalence and impact of founder mutations in hereditary breast cancer in Latin America. Genet. Mol. Biol. 2014; Mar. 37(Suppl. 1), 234-40
Besic N., Satej N., Ratosa I., Gojkovic Horvat A., Marinko T., Gazic B., Petric R. : Long-term use of metformin and the molecular subtype in invasive breast carcinoma patients; a retrospective study of clinical and tumor characteristics. BMC Cancer 2014; Apr. 28, 14(1), 298
Bhatti A.B., Khan A.I., Siddiqui N., Muzaffar N., Syed A.A., Shah M.A., Jamshed A. :
Outcomes of triple-negative versus non-triple-negative breast cancers managed with breast-conserving therapy. Asian Pac. J. Cancer Prev. 2014; 15(6), 2577-81
Bombard Y., Rozmovits L., Trudeau M.E., Leighl N.B., Deal K., Marshall D.A. : Patients' perceptions of gene expression profiling in breast cancer treatment decisions. Curr. Oncol. 2014; Apr. 21(2)
Carrasco E., Alvarez P.J., Prados J., Melguizo C., Rama A.R., Aránega A., Rodríguez-Serrano F. : Cancer stem cells and their implication in breast cancer. Eur. J. Clin. Invest. 2014; Apr. 27
Cetin I., Topcul M. : Triple Negative Breast Cancer. Asian Pac. J. Cancer Prev. 2014; 15(6), 2427-2431
Eisemann N., Waldmann A., Katalinic A. : Epidemiology of breast cancer; current figures and trends. Geburtshilfe Frauenheilkd. 2013; Feb.73(2), 130-135
Emond J.A., Pierce J.P., Natarajan L., Gapuz L.R., Nguyen J., Parker B.A., Varki N.M., Patterson R.E. : Risk of breast cancer recurrence associated with carbohydrate intake and tissue expression of IGF-1 receptor. Cancer Epidemiol. Biomarkers Prev. 2014; Apr. 22
Fasching P.A., Ekici A.B., Wachter D.L., Hein A., Bayer C.M., Häberle L., Loehberg C.R., Schneider M., Jud S.M., Heusinger K., Rübner M., Rauh C., Bani M.R., Lux M.P., Schulz-Wendtland R., Hartmann .A, Beckmann M.W. : Breast cancer risk; from genetics to molecular understanding of pathogenesis. Geburtshilfe Frauenheilkd. 2013; Dec.73(12), 1228-1235
Gooch J., King T.A., Eaton A., Dengel L., Stempel M., Corben A.D., Morrow M. : The extent of extracapsular extension may influence the need for axillary lymphnode dissection in patients with T1-T2 breast cancer. Ann. Surg. Oncol. 2014; Apr. 29
Ha J.H., Seong M.K., Kim E.K., Lee J.K., Seol H., Lee J.Y., Byeon J., Sohn Y.J., Koh J.S., Park I.C., Noh W.C., Kim H.A. : Serial serum HER2 measurements for the detection of breast cancer recurrence in HER2 positive patients. J. Breast Cancer 2014; Mar. 17(1), 33-9.
Heger Z., Rodrigo M.A., Krizkova S., Zitka O., Beklova M., Kizek R., Adam V. : Identification of estrogen receptor proteins in breast cancer cells using matrix-assisted laser desorption/ionization time of flight mass spectrometry (Review). Oncol. Lett. 2014; May 7(5), 1341-44
Heywang-Koebrunner S., Bock K., Heindel W., Hecht G., Regitz-Jedermann L., Hacker A., Kaeaeb-Sanyal V. : Mammography screening as of 2013. Geburtshilfe Frauenheilkd. 2013; Oct. 73(10), 1007-1016
Howlader N., Altekruse S.F., Li C.I., Chen V.W., Clarke C.A., Ries L.A., Cronin K.A. : US incidence of breast cancer subtypes defined by joint hormone receptor and HER2 status.
J. Natl. Cancer Inst. 2014; Apr. 28
Kashcheev V.V., Pryakhin E.A., Menyaylo A.N., Chekin S.Y., Ivanov V.K. : Comparing risk estimates following diagnostic CT radiation exposures employing different methodological approaches. Health Phys. 2014; Jun. 106(6), 806-11
Kobayashi R., Shiraishi K., Iwase S., Ohtomo K., Nakagawa K. : Omission of axillary lymphnode dissection for clinically node negative early-stage breast cancer patients. Breast Cancer 2014; Apr. 23
Kwast A.B., Voogd A.C., Menke-Pluijmers M.B., Linn S.C., Sonke G.S., Kiemeney L.A., Siesling S. : Prognostic factors for survival in metastatic breast cancer by hormone receptor status. Breast Cancer Res. Treat. 2014; Apr. 26
Janni W., K Hn T., Schwentner L., Kreienberg R., Fehm T., Wöckel A. : Sentinel node biopsy and axillary dissection in breast cancer: the evidence and its limits. Dtsch. Arztebl. Int. 2014; Apr. 4, 111-14
Liu N.Q., De Marchi T., Timmermans A.M., Beekhof R., Trapman-Jansen A.M., Foekens R., Look M.P., van Deurzen C.H., Span P.N., Sweep F.C., Brask J.B., Timmermans-Wielenga V., Debets R., Martens J.W., Foekens J.A., Umar A. : Ferritin heavy chain in triple negative breast cancer: a favorable prognostic marker that relates to a CD8+ effector T-cell response.
Mol. Cell Proteomics 2014; Apr. 17
Martelli G., Boracchi P., Orenti A., Lozza L., Maugeri I., Vetrella G., Agresti R. : Axillary dissection versus no axillary dissection in older T1N0 breast cancer patients: 15 years results of trial and out-trial patients. Eur. J. Surg. Oncol. 2014; Apr. 13
Miller C.P., Thorpe J.D., Kortum A.N., Coy C.M., Cheng W.Y., Ou Yang T.H., Anastassiou D., Beatty J.D., Urban N.D., Blau C.A. : JAK2 expression is associated with tumor infiltrating lymphocytes and improved breast cancer outcomes: implications for evaluating JAK2 inhibitors.
Cancer Immunol. Res. 2014; Apr. 2(4), 301-6
Nakamiya N., Ueda S., Shigekawa T., Takeuchi H., Sano H., Hirokawa E., Shimada H., Suzuki H., Oda M., Osaki A., Saeki T. : Clinicopathological and prognostic impact of imaging of breast cancer angiogenesis and hypoxia using diffuse optical spectroscopy. Cancer Sci. 2014; Apr. 26
Newitt D.C., Aliu S.O., Witcomb N., Sela G., Kornak J., Esserman L., Hylton N.M. : Realtime measurement of functional tumor volume by MRI to assess treatment response in breast cancer neoadjuvant clinical trials: validation of the aegis SER software platform. Transl. Oncol. 2014; Feb. 1, 7(1), 94-100
Powles T.J. : Selective oestrogen receptor modulators (SERMs) for prevention of breast cancer.
Natl. Med. J. India 2013; Jul.-Aug. 26(4), 194-6
Sanghera B., Wong W.L., Sonoda L.I., Beynon G., Makris A., Woolf D., Ardeshna K. : FLT PET-CT in evaluation of treatment response. Indian J. Nucl. Med. 2014; Apr. 29(2), 65-73
Shi X.J., Au W.W., Wu K.S., Chen L.X., Lin K. : Mortality characteristics and prediction of female breast cancer in china from 1991 to 2011. Asian Pac. J. Cancer Prev. 2014; 15(6), 2785-91
Sims T.T., Fallen T.J., Dungan J.S., Shulman L.P. : Testing for familial BRCA1-2 mutations: implications for genetic counseling and risk assessment. Obstet. Gynecol. 2014; May 123 (Suppl. 1), 185-6
Singh R., Gupta S., Pawar S.B., Pawar R.S., Gandham S.V., Prabhudesai S. : Evaluation of ER, PR and HER-2 receptor expression in breast cancer patients presenting to a semi urban cancer center in Western India. J. Cancer Res. Ther. 2014; Jan.-Mar.10(1), 26-8
Sinn P., Aulmann S., Wirtz R., Schott S., Marmé F., Varga Z., Lebeau A., Kreipe H., Schneeweiss A. : Multigene assays for classification, prognosis, and prediction in breast cancer: a critical review on the background and clinical utility. Geburtshilfe Frauenheilkd. 2013; Sep.73(9), 932-940.
Veta M., Pluim J.P., van Diest P.J., Viergever M.A. : Breast cancer histopathology image analysis: a review. IEEE Trans Biomed. Eng. 2014; May. 61(5), 1400-11
Wu L.Z., Han R.Q., Zhou J.Y., Yang J., Dong M.H., Qian Y., Wu M. : Incidence and mortality of female breast cancer in Jiangsu, China.Asian Pac. J. Cancer Prev. 2014; 15(6), 2727-32



