Chirurgia della Mammella (3/4)
- Dettagli
- Categoria: Lezioni
- Pubblicato Lunedì, 11 Agosto 2014 16:25
- Scritto da Paolo Purri
- Visite: 12895
  INTRODUZIONE (diapositive 1-9) L'esame istopatologico di una neoplasia mammaria rende possibile l'acquisizione di informazioni atte a stabilire l'esatta diagnosi della lesione, a preconizzare la prognosi della paziente, a facilitare la conoscenza delle caratteristiche biologiche della malattia. La classificazione più diffusamente usata per i carcinomi mammari fa riferimento ai parametri indicati dalla Organizzazione Mondiale della Sanità (WHO - World Helth Organization), in base ai quali i tumori sono distinti in tubulari o lobulari, indicando con ciò le strutture anatomiche di partenza e le componenti citologiche riconosciute; anche se non si deve trascurare il fatto che la maggior parte dei tumori origina nei dotti terminali, indipendentemente dal tipo istologico. Pertanto, riferendosi alle componenti istologiche si riconoscono forme neoplastiche pure (diapositiva 6) e forme miste, per combinazione con carcinoma duttale infiltrante NOS (non altrimenti specificato - diapositiva 8) e senza partecipazione del precedente (diapositiva 9); a queste va aggiunta la malattia di Paget del capezzolo, nelle varie opportunità di combinazione con il carcinoma intraduttale ed il carcinoma duttale infiltrante (diapositiva 7). Con riferimento alla struttura anatomica di origine si riconoscono (diapositiva 5) carcinomi duttali (infiltranti e non), carcinomi lobulari (infiltranti e non), carcinomi rari, sarcomi e la già citata malattia di Paget del capezzolo.  |
 |
02.  |
|
|
 04.  |
 |
05.  |
 06.  |
 |
07.  |
 08.  |
 |
09.  CARATTERISTICHE PER ISTOTIPO (diapositive 12-32)  Carcinoma Non Invasivo (diapositive 10-12) Tra le varie forme neoplastiche si annovera il carcinoma "in situ"; si tratta di una neoplasia ad insorgenza dall'epitelio duttale, confinata entro lo spessore parietale senza superamento della membrana basale dello strato epiteliale. Per esattezza la struttura istologica richiama anche la possibilità di una origine nell'epitelio lobulare (carcinoma lobulare "in situ"), per cui si classifica come duttale o lobulare in riferimento al quadro istologico ed alle caratteristiche di crescita. Gli acronimi DCIS e LCIS (il primo definito anche intraduttale o duttale non-invasivo) si riferiscono a neoplasie con caratteristica proliferazione epiteliale maligna senza invasione dello stroma di sostegno. Il quadro del carcinoma duttale non invasivo può rappresentare una sorta di fase intermedia nell'ambito della progressione dall'iperplasia papillare benigna fino al carcinoma infiltrante; proprio la distinzione con l'iperplasia può a volte essere difficile, sotto il profilo istologico, per la mescolanza di aree francamente neoplastiche con altre di sola atipia cellulare; è caratteristico l'aspetto di gruppi cellulari a formare papille, senza coesione, con franco disorientamento e pleiomorfismo, con occasionali figure mitotiche, ma tassativamente senza interessamento della membrana basale. Il comedocarcinoma (del tipo non invasivo) ne rappresenta la forma più drammatica per la completa ostruzione di un consistente tratto del dotto ad opera di una marcata iperplasia cellulare, spesso preda di necrosi nel contesto della massa cellulare stessa; la compressione o schiacciamento determina l'espulsione di caratteristici tasselli di comedoni (da cui la denominazione della neoplasia).  |
 |
10.  |
 |
11.  |
 12.  Carcinoma papillare infiltrante (diapositive 13-14) Presumibilmente rappresenta uno stadio tardivo o una forma più aggressiva di un carcinoma papillare non invasivo; ha tendenza ad uno sviluppo lento con conseguente sopravvivenza a 5 anni migliore della media di tutti i carcinomi mammari. Caratteristicamente si presenta come massa soffice alla palpazione (contrariamente alla consistenza dura e compatta delle altre neoplasie per l'immancabile componente fibrosa) che può raggiungere grandi dimensioni prima di produrre metastasi in sede ascellare; è inusuale la presenza di edema o retrazione della cute sovrastante la lesione, indice di una tardiva infiltrazione linfatica e di un insufficiente stimolo ad una risposta fibrosa. Nella variante comedocarcinomatosa rappresenta il 5% di tutti i tumori mammari, spesso in associazione con altre forme tumorali con tendenza alla fibrosi che tuttavia non altera significativamente la prognosi.  |
 |
13.  |
 14.  Carcinoma duttale infiltrante Comprende una varietà di carcinomi a tendenza invasiva, nei quali non si riconosce uno specifico aspetto istologico; per questo motivo sono identificati con l'acronimo NOS (not otherwise specified). E' di gran lunga la forma neoplastica più comunemente incontrata (70% di tutti i tumori mammari); quando la componente fibrosa, in associazione ad aree di DCIS, è marcata identifica il tipo di carcinoma scirroso, di fibrocarcinoma o di carcinoma sclerosante. Generalmente metastatizza ai linfonodi del cavo ascellare omolaterale e per la variabilità delle componenti istologiche giustifica la peggiore prognosi riscontrata fra tutti i tipi di carcinoma duttale.  |
 |
15.  Carcinoma midollare (diapositive 16-17) Rappresenta il 5% di tutti i tumori della mammella e si appalesa come una lesione circoscritta, a volte anche di ampie dimensioni, con caratteristiche di basso grado di infiltrazione; ne consegue una prognosi decisamente favorevole, anche in presenza di metastasi. La sopravvivenza media assoluta a 5 anni oscilla tra 85% e 90%, offrendo attese di vita dopo il trattamento decisamente migliori di quelle per i carcinomi duttali NOS. L'aspetto macroscopico è quello di masse mobili, di dimensioni variabili; le più piccole spesso si confondono con lesioni benigne del tipo di cisti o fibroadenomi; il quadro istologico attira l'attenzione per l'associazione di grandi cellule rotonde o poligonali con abbondante citoplasma e nuclei poco differenziati, di provenienza epiteliale duttale, con infiltrali linfo-plasmacellulari; sono frequenti aree necrotiche di dimensioni variabili. Le metastasi ascellari sono certamente meno frequenti che in altri carcinomi della mammella e generalmente sono limitate ad un solo linfonodo.  |
 |
16.  |
 |
17.  Carcinoma tubulare (diapositiva 18-19) Definito anche "carcinoma ben differenziato" ed oggetto di attenzione solo da tempo relativamente recente, rappresenta la forma neoplastica caratterizzata da almeno 75% di struttura tubulare. Per le sue caratteristiche può facilmente essere confuso con l'adenosi duttale o sclerosante; in forma pura si presenta in poco più dello 1% dei casi, mentre quasi sempre mostra combinazione con altre forme istologiche. Le metastasi ascellari non sono affatto frequenti e la prognosi è decisamente favorevole, specie quando la componente tubulare supera il 90% della massa neoplastica, con sopravvivenze a lungo termine che si approssimano al 100% dei casi.  |
 |
18.  |
 |
19.  Carcinoma mucinoso Definito anche "carcinoma colloide", rappresenta un'altra forma di neoplasia duttale; con una incidenza nell'ordine del 3% di tutti i tumori mammari, ha la caratteristica istologica di aspetti a nidi e cordoni cellulari immersi in una matrice mucinosa. La sua lenta crescita consente il raggiungimento di proporzioni anche abbastanza voluminose prima dell'identificazione clinica, anche a causa della consistenza molle e dai margini maldefiniti. La sopravvivenza è generalmente migliore che nella media delle altre neoplasie mammarie; quanto maggiore è la quota di mucina presente tanto migliore è la prognosi. Varianti di più raro riscontro sono rappresentate da carcinomi adenocistici e carcinomi duttali metaplasici, che in molti casi occupano piccole aree di carcinomi duttali NOS.  |
 20.  Carcinoma lobulare infiltrante (diapositive 21-23) Relativamente poco frequente (5 -> 10% dei casi), origina dall'epitelio di rivestimento dei lobuli ghiandolari o dei dotti terminali. Il rilievo clinico è caratteristico, rappresentato da un'area di ispessimento maldefinito della mammella, in contrapposizione con il riscontro di noduli compatti che identifica le forme duttali. Nel corso del loro sviluppo i lobuli mammari dell'area interessata tendono ad allargarsi e successivamente ad occludersi per l'iperplasia dello strato cellulare di rivestimento; nella fase di lesione "in situ" questi sono i soli aspetti istologici, così che una semplice ablazione chirurgica modulata (quadrantectomia -> mastectomia, secondo necessità) risulta già curativa. Tuttavia nella sua evoluzione la lesione tende ad infiltrare gli strati limitrofi fino a dar luogo ad un carcinoma scirroso. Una caratteristica di questa neoplasia è la multicentricità, sia mono- che bilaterale (diversamente dai carcinomi duttali NOS); la tendenza all'infiltrazione linfonodale ascellare e la prognosi risultano invece sovrapponibili a quelle registrate per ca. duttali infiltranti, mentre diverse sono le aree somatiche interessate da infiltrazione focale a distanza. Merita particolare attenzione il riscontro, nel 90% circa dei casi, di associazione del carcinoma lobulare, nella fase "in situ", con altri tipi di neoplasia anch'esse "in situ"; questo vale anche, sia pure in percentuale minore (35-60% dei casi), per le lesioni controlaterali in caso di neoplasie bilaterali.  |
 21.  |
 22.  |
 23.  Sarcoma mammario (diapositive 24-26) E' una neoplasia molto rara, più frequentemente sotto forma di cistosarcoma filloide. A dispetto della terminologia, ha bassissima incidenza di vera malignità (1:10 casi osservati); la maggioranza dei casi benigni è identificato con la denominazione di fibroadenoma intracanalicolare o pericanalicolare gigante, e ancora di mixoma intracanalicolare. Tipicamente dell'età avanzata, è caratterizzato da una prevalenza della componente stromale su quella fibroadenomatosa; le dimensioni di alcuni centimetri all'atto dell'identificazione clinica, unitamente alla consistenza dura ed all'aspetto bozzuto, favoriscono una corretta diagnosi, suffragata dai rilievi microscopici di aspetti a foglia per protrusioni intracanalicolari nelle lesioni più piccole e di spazi cistici occupati da masse polipoidi nelle lesioni più grandi. La variante maligna determina metastatizzazione nel sottocutaneo e nel polmone; assai rara è l'infiltrazione linfodale ascellare, così da giustificare ampiamente il ricorso alla mastectomia semplice per il trattamento sia delle forme benigne che di quelle maligne.  |
 24.  |
 25.  |
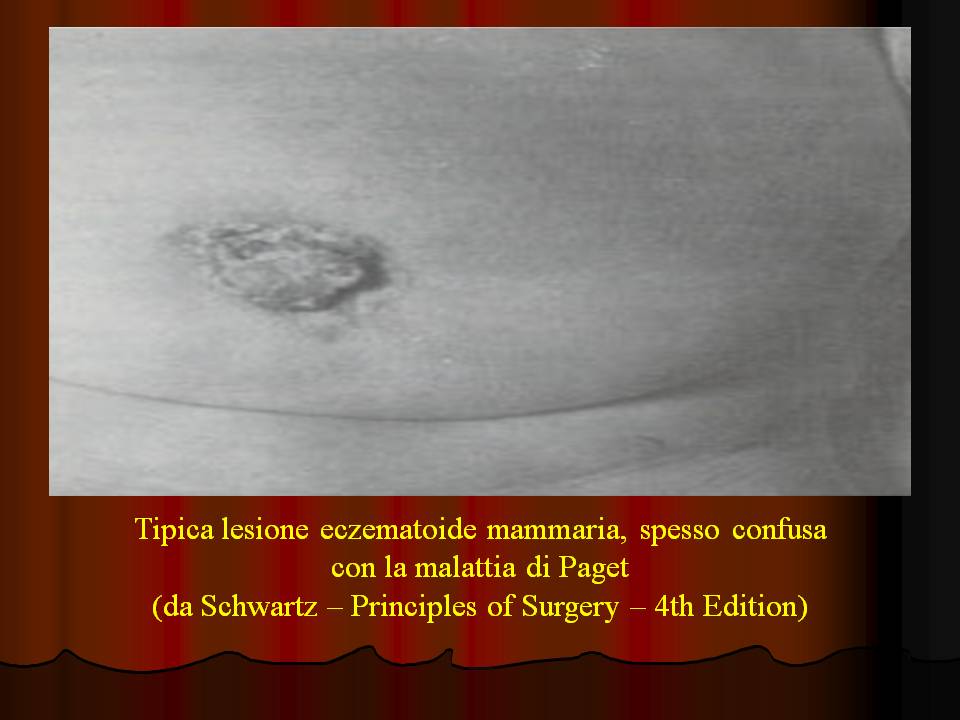
 26.  Malattia di Paget (diapositive 27-28) E' una patologia poco frequente, caratterizzata da una lunga storia di espressioni eczematose a carico sia dell'areola mammaria che del capezzolo, con prurito, bruciore, trasudazione e sanguinamento (variamente combinati tra loro). Il riscontro palpatorio di un nodulo compatto in prossimità del capezzolo fornisce prova dell'esistenza di una lesione maligna, sia del tipo intraduttale che duttale infiltrante; istologicamente lo strato epidermico del capezzolo contiene cellule neoplastiche sparse o raccolte in nidi; la prognosi è strettamente correlata con quella del tipo istologico della neoplasia associata.  |
 27.  |
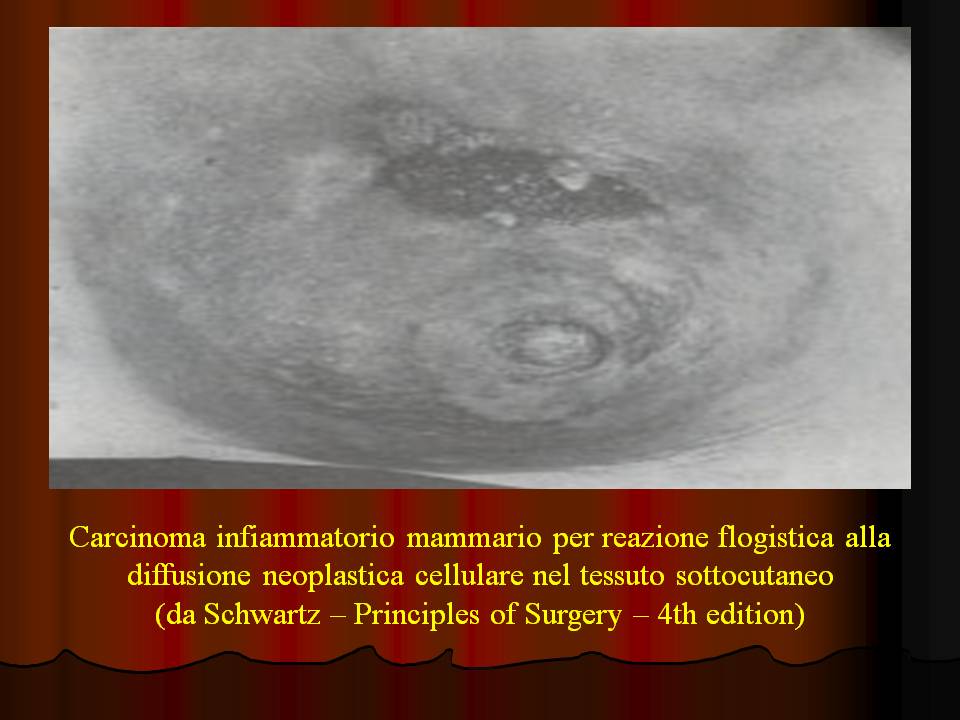
 28.  Carcinoma infiammatorio (diapositive 29-32) La caratteristica clinica è dominata dall'edema della cute dell'area mammaria interessata dal processo, accompagnato da arrosamento e rialzo termico locale, con margini francamente eresipelatoidi ed indurimento del tessuto sottostante. Questi aspetti macroscopici sono corroborati dai rilievi microscopici che evidenziano una proliferazione cellulare cancerosa nei linfatici del derma; è raro il riscontro di cellule infiammatorie. La prognosi è infausta, anche se la lesione appare localizzata.  |
 29.  |
 30.  |
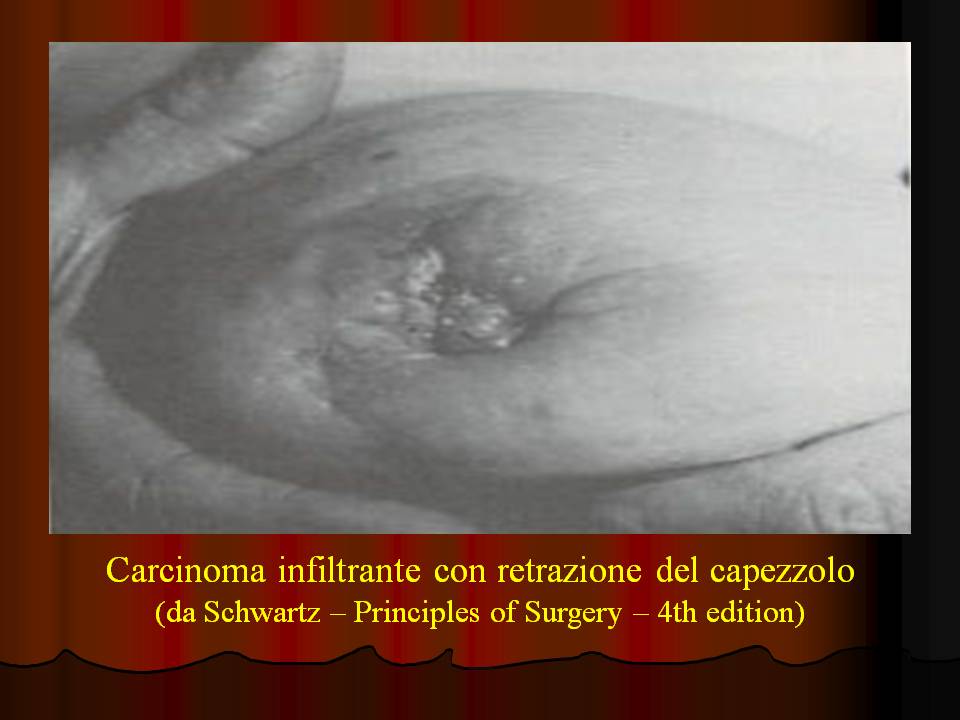 31.  |
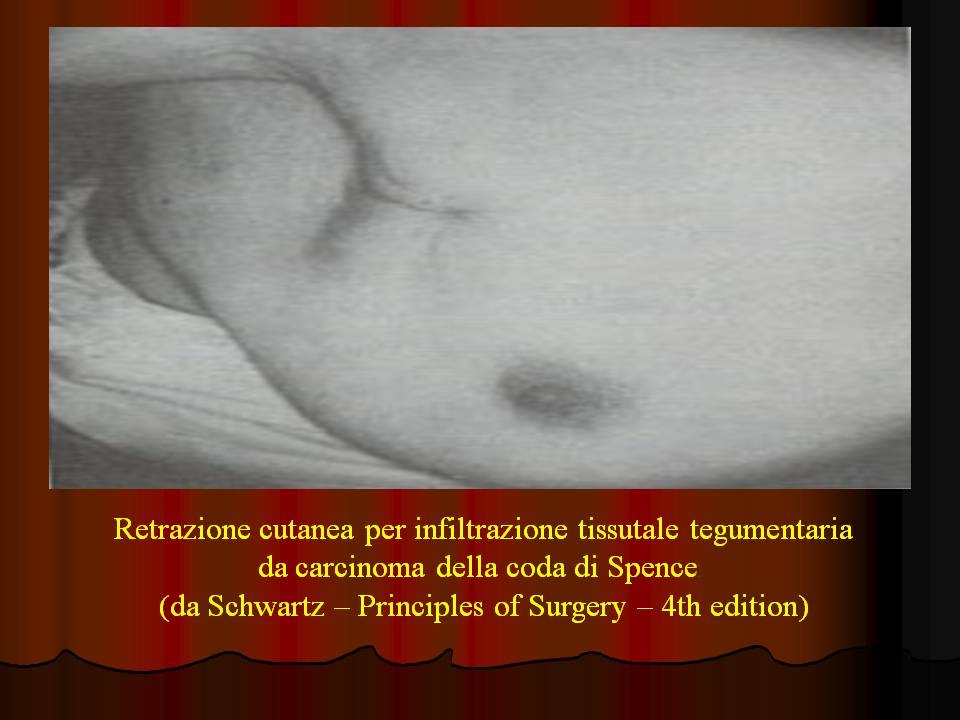 32.  RELAZIONE TRA ASPETTI MICROSCOPICI E PROGNOSI (diapositive 33-36) I parametri valutativi che maggiormente incidono sulla predittività prognostica delle neoplasie mammarie sono senz'altro il grado di differenziazione istologica e la presenza di invasione linfoghiandolare. A questi vanno aggiunti caratteri di minore rilevanza, anche se non del tutto secondari, come il livello di differenziazione dei nuclei cellulari, l'eventuale presenza di aree di necrosi tissutale, la frequenza di mitosi ed il comportamento reattivo delle componenti cellulari del tumore; tutti questi fattori, rapportati allo stadio della malattia, consentono di valutare il percorso evolutivo della neoplasia. Il "grading" del tumore si riferisce alla possibilità di riconoscere la struttura di origine della neoplasia (dotti o alveoli ghiandolari), le dimensioni dei nuclei cellulari, il livello di cromatina citoplasmatica, il numero di mitosi presenti: tutti elementi che consentono la classificazione in tre gradi di differenziazione (grado I-II-III), il terzo dei quali raggruppa le neoplasie a più elevato indice di malignità e quindi gravate della peggiore prognosi. In presenza di positività linfonodale il "grading istologico" è solo indicativo del "passo" della neoplasia; mentre in assenza di impegno linfonodale assume valore prognostivo a lungo termine. L'infiltrazione linfatica - nell'ordine del 25% di tutte le neoplasie mammarie - dipende dalla presenza di emboli neoplastici nel lume dei vasi linfatici della ghiandola; la sua valutazione deve essere fatta sul tessuto adiacente alla lesione tumorale.  |
 33.  |
 34.  |
 35.  |
 36.  RELAZIONE TRA ASPETTI BIOLOGICI E PROGNOSI (diapositive 37-40) Maggiore incidenza sulla predittività prognostica hanno certamente le caratteristiche biologiche delle neoplasie; queste sono rappresentate dalla presenza dei recettori estro-progestinici cellulari, dai livelli di cinetica cellulare, dall'entità del DNA-content, dall'espressione oncogenetica del tumore. Detto già in precedenza del significato dei recettori ormonali, c'è da soffermarsi invece maggiormente sul valore del "labelling index" come misuratore della cinesi e dell'attività proliferativa cellulare neoplastica. Questo indicatore dell'attività mitotica cellulare risulta predittivo sia di ripresa di malattia che di elevata mortalità; inoltre dimostra stretta correlazione con il grado di differenziazione istologica della neoplasia, non con le sue dimensioni o con l'estensione di impegno linfonodale ascellare. Proprio a questo proposito è rilevante il suo significato prognostico in assenza di positività linfonodale; così come il fatto che risulti indipendente dallo stadio clinico e patologico della malattia ed inversamente correlato con i livelli di recettori ormonali del tumore. Nella valutazione degli indici di predittività delle neoplasie mammarie trova ampia attendibilità l'interrelazione esistente tra aneuploidia (variazione nel numero dei cromosomi rispetto a quello che normalmente caratterizza le cellule di un individuo della stessa specie) e prognosi; infatti soggetti con neoplasie aneuploidi mostrano una prognosi a breve termine decisamente peggiore di quelli con tumori diploidi. Questo introduce la correlazione tra "DNA-content, SPF (frazione della fase S) e ERP (proteina recettoriale estrinica)" nelle valutazioni prognostiche di ogni singola forma neoplastica, ma non nella guida alle scelte terapeutiche. In epoca relativamente recente si è riconosciuta una specifica valenza prognostica alla determinazione dell'espressione oncogenetica dei tumori mammari; in particolare si è puntata l'attenzione sul significato della presenza dell'oncogene HER-2/neu. I risultati di numerose ricerche indicano che almeno il 35% delle neoplasie mostrano un incremento di questo fattore, indipendentemente dalla positività per recettori ormonali (ERP e PgRP), dalle dimensioni del tumore e dal numero di linfonodi interessati; è risultato rilevante, in proiezione prognostica, l'incremento del suddetto oncogene in combinazione con il numero di linfonodi ascellari positivi.  |
 37.  |
 38.  |
 39.  |
 40.  MODALITA' DI DIFFUSIONE (diapositive 41-48) Nel corso del suo sviluppo ogni neoplasia mammaria manifesta una diffusione sia locale che regionale; nell'ambito di quest'ultima si deve considerare l'invasione linfonodale e la formazione di focolai metastatici. L'origine della lesione primaria è localizzata in un quadrante della ghiandola, con netta prevalenza di quello superiore esterno sugli altri; il rapporto di incidenza tra la metà esterna e la metà interna è di 3:1 (60% contro 20%). Quanto al restante 20%, una larga percentuale (17%) è coperta dalla sede definita centrale (entro 1 cm. dall'areola mammaria), con una esigua percentuale (3%) lasciata alle rappresentazioni diffuse. La maggior frequenza di localizzazioni nel quadrante supero-esterno è determinata dalla maggior quantità di tessuto ghiandolare ivi presente. Non si rilevano differenze in termini di sopravvivenza in relazione alla localizzazione del tumore nell'ambito dei vari quadranti, essendo il grado di differenziazione istologica e l'entità dell'impegno linfonodale gli unici parametri in grado di incidere significativamente sia sulla ripresa di malattia che sulla sopravvivenza in assoluto. La progressione in fase di accrescimento si realizza per infiltrazione diretta del parenchima ghiandolare, sia lungo i dotti ghiandolari che attraverso i vasi linfatici; detta progressione assume una morfologia ramificata, con il caratteristico aspetto stellato. Nel suo sviluppo verso la cute e verso la fascia pettorale determina l'eventuale retrazione cutanea e la fissità della lesione rilevata alla palpazione; inoltre, la diffusione attraverso la rete linfatica parenchimale e attraverso la fascia suddetta crea i presupposti per sconfinamento della patologia oltre la sede della lesione palpabile. L'importanza dell'identificazione dell'impegno linfonodale è confermata dalla percentule di interessamento (40-50%) riscontrata sia in fase diagnostica che in corso di trattamento chirurgico, con prevalenza per le localizzazioni nei quadranti esterni su quelle nei quadranti interni della ghiandola; l'entità dell'invasione linfoghiandolare appare strettamente dipendente dalle dimensioni della lesione e incide sensibilmente sugli indici di sopravvivenza determinando una prognosi che risulta inversamente proporzionale al numero di linfonodi coinvolti nel processo neoplastico. La suddivisione dei linfonodi ascellari in tre livelli (diapositiva 45) favorisce anche la valutazione clinico-prognostica della lesione neoplastica, sia in termini di estensione della malattia che di sopravvivenza (peggiore quanto più distale è il livello di linfonodi coinvolti). L'interessamento dei linfonodi mammari interni (intratoracici) è specifico - ma non esclusivo - delle lesioni site nei quadranti interni e nell'area centrale della mammella; certamente meno frequente della diffusione ascellare, è inusuale in concomitanza con la positività in sede ascellare. Vi è correlazione con le dimensioni della lesione primaria, risultando meno frequente (< 20%) per lesioni sotto i 5 cm. di diametro che per lesioni oltre queste dimensioni (> 35%). Un dato importante è fornito dalla valutazione della sopravvivenza a 10 anni in assenza di ripresa di malattia, che risulta elevata (circa 75%) per negatività linfonodale sia ascellare che mammaria interna, mediamente elevata (circa 50%) per positività delle sole stazioni ascellari e bassa (intorno al 25%) per positività di entrambe le stazioni. Il superamento della sede ascellare determina il coinvolgimento dei linfonodi siti nella fossa sovraclaveare; questo indica uno stadio allargato di impegno linfonodale con conseguente peggioramento della prognosi e giustifica una maggiore estensione di exeresi chirurgica (mastectomia radicale allargata).  |
 41.  |
 42.  |
 43.  |
 44.  |
 45.  |
 46.  |
 47.  |
 48.  STADIAZIONE CLINICA E PATOLOGICA (diapositive 49-57) Si riferisce all'aggruppamento dei soggetti affetti in riferimento all'estensione della malattia e si distingue in clinica e patologica; è di assoluto interesse per la scelta del programma terapeutico e per la valutazione prognostica, avvalendosi dei risultati delle diverse strategie adottate. La stadiazione clinica è realizzata sulla scorta dei rilievi obiettivi in corso di esame fisico, suffragati dal supporto del laboratorio e dell'indagine radiologica tradizionale e per immagini; quella patologica si avvale invece dei riscontri istologici sui campioni chirurgici. In entrambe le classificazioni si considerano le dimensioni della lesione, il numero dei linfonodi interessati e l'entità di interessamento nel contesto del linfonodo stesso, il numero e le sedi di metastasi a distanza. I parametri di valutazione relativi alla lesione (come riportato nelle diapositive 50 e 51) riguardano le dimensioni e l'eventuale fissità della massa alla fascia ed al muscolo pettorale, nonchè aspetti di edema, iperemia ed ulcerazioni a carico della cute sovrastante. Quanto all'interessamento linfonodale (diapositiva 53) si prendono in considerazione la sede (marginali, intermedi e distali) ed il grado di crescita neoplastica nel contesto della struttura impegnata (parziale o totale, con o senza invasione della capsula). Riguardo alle metastasi (diapositiva 54) la stadiazione tiene conto della assenza o presenza di queste, considerando nella positività anche il riscontro di interessamento della cute in aree lontane dalla mammella. La combinazione di queste specifiche componenti consente la stadiazione clinica delle neoplasie in quattro grandi gruppi, ognuno dei quali suddiviso in sottogruppi in merito a distinzioni più dettagliate per ogni singola componente (sistema TNM); la stadiazione patologica (diapositive 56 e 57) esaspera ulteriormente questa meticolosità, distinguendo in particolare per l'impegno linfonodale la metastasi dalla micrometastasi e valutando l'estensione dell'espressione neoplastica entro i confini capsulari.  |
 49.  |
 50.  |
 51.  |
 52.  |
 53.  |
 54.  |
 55.  |
 56.  |
 57.  VALUTAZIONI PRE-TRATTAMENTO (diapositive 58-64) E' ormai diffusamente riconosciuto il valore di un'approfondita valutazione clinica in funzione di una strategia terapeutica mirata; partendo dalla storia clinica familiare fino alle più sofisticate indagini diagnostiche, tutte le informazioni raccolte orientano verso un programma specifico caso per caso. Aldilà dell'anamnesi, dell'esame clinico e delle indagini biochimiche di ampio spettro - comuni a tutte le patologie neoplastiche - la scintigrafia ossea si dimostra di grande utilità per il trattamento di neoplasie mammarie al III stadio (in cui la positività per metastasi raggiunge il 25% dei casi); assai meno nei primi due stadi, anche se la sua esecuzione prima dell'intervento risulta sempre utile per un confronto post-operatorio nell'ambito del controllo dell'evoluzione della malattia. Alla stessa maniera una scintigrafia epatica non è imperativa in ogni caso, bensì in presenza di variazioni morfologiche e funzionali dell'organo. E' bene richiamare l'attenzione sul fatto che spesso ci si imbatte in falsi negativi con entrambe le metodiche citate, per cui è imperativo valutare le informazioni acquisite nel contesto di un'analisi globale che tenga conto anche di altri risultati derivanti da tutte le indagini preliminari. L'esame mammografico - sempre bilaterale - deve essere completato con biopsia (preferibilmente eco-guidata) in tutte le condizioni di massa ghiandolare sospetta; l'esplorazione della mammella controlaterale, in presenza di positività neoplastica accertata, è imperativa per l'eventualità di multicentricità o di bilateralità della forma tumorale identificata, oltre che per suggerire eventuali trattamenti aggiuntivi (radioterapia, possibile mastectomia) in casi già sottoposti a procedure conservative. Pur restringendo l'utilità - a fronte dei costi e degli effetti radiogeni - della tomografia e della risonanza ai soli fini diagnostici mammari, non si può disconoscerne il valore per il rilevamento di lesioni metastatiche in assenza di una sintomatologia specifica; tuttavia non ci si deve lasciar prendere la mano per un utilizzo eccessivo, aldilà di applicazioni complementari a valutazioni cliniche assolutamente prioritarie. Un'area di crescente interesse è quella dei biomarcatori (CEA, MSA, hCG, ferritina: tutti mostrano scarso valore diagnostico primario, con elevato tasso di falsi negativi, mentre si dimostrano di grande ausilio nel monitoraggio di soggetti trattati, con percentuali oscillanti tra 50% e 70% di positività in presenza di metastasi; inoltre dimostrano un elevato valore predittivo prognostico (diapositiva 64) in merito alle possibilità di recidiva neoplastica a breve e medio termine.  |
 58.  |
 59.  |
 60.  |
 61.  |
 62.  |
 63.  |
 64.  IL PROBLEMA DELLA MULTICENTRICITA' (diapositive 65-66) Le casistiche più accreditate riportano di una incidenza di neoplasie mammarie multifocali compresa tra il 10% ed il 75%. La discrepanza così ampia si spiega con tre fattori: diversa precisione nella definizione di multicentricità, differenti tecniche di esame dei campioni chirurgici, diversa estensione dei tessuti ghiandolari asportati. Si è visto, infatti, che l'ablazione di sezioni di tessuto mammario in quadranti diversi da quello dove è localizzato il tumore consente di repertare nuovi focolai neoplastici che documentano la multicentricità della lesione primaria. Il problema è tutt'altro che irrilevante, specie quando si consideri che una percentuale pari a circa 45% dei carcinomi occulti (non palpabili) rilevati con l'indagine mammografica presenta multicentricità; e tale percentuale cresce fino a 60% se queste neoplasie mostrano una microinvasività patologica, come per i carcinomi in situ. Un altro aspetto importante del problema è evidenziato dai riscontri di focolai neoplastici oltre il limite di 5 cm. dai confini di una lesione asportata con procedura conservativa (quadrantectomia o tumorectomia), secondo una percentuale intorno al 20% dei casi; nella pratica corrente si è verificato che per lesioni neoplastiche inferiori a 2 cm. di diametro la multicentricità è risultata pari al 25%, mentre per lesioni superiori a 2 cm. ha raggiunto anche il 40%. Quanto detto induce a valutare se la multicentricità è indicativa di attività clinica del tumore o piuttosto di un fenomeno indipendente da caratteristiche biologiche della neoplasia primaria; al momento sembra potersi affermare che una certa percentuale di lesoni in situ (sia tubulari che lobulari) sviluppa nel tempo una qualche caratteristica di invasività. Questo è suffragato dal mancato riscontro autoptico di neoplasie mammarie in donne decedute per cause non neoplastiche, a differenza di quanto avviene per il carcinoma della prostata nell'uomo; a conferma del fatto che una neoplasia mammaria si manifesta sempre clinicamente nell'arco della vita del soggetto che ne risulti affetto.  |
 65.  |
 66.  IL PROBLEMA DELL'INTERESSAMENTO LINFONODALE (diapositive 67-69) La positività linfonodale indirizza verso la necessità di un procedimento ablativo, la cui esecuzione fornisce : 1) informazioni utili alla predittività prognostica ed alla pianificazione di trattamenti complementari; 2) limitazioni alle possibilità di diffusione della patologia verso sedi lontane dalla mammella, così come contenimento della quota di irradiazioni per piani di trattamento combinato chirurgico e radiante; 3) allungamento dell'intervallo libero da malattia in caso di positività linfododale, se comparato con quanto avviene in assenza di linfoadenectomia associata all'exeresi neoplastica mammaria; di certo, tuttavia, non c'è da attendersi che il "cleaning" linfonodale abbia alcuna incidenza sulla sopravvivenza del soggetto colpito dalla neoplasia; 4) effetti palliativi sulla sintomatologia dolorosa ascrivibile al coinvolgimento neoplastico dei fasci neurovascolari. In linea di massima la dissezione linfonodale ascellare ha finalità stadiative più che terapeutiche, ma il limite di estensione necessaria non è codificato. E' importante considerare, tuttavia, che una dissezione incompleta sottostima il grado di diffusione metastatica del tumore, oltre che espone al rischio di lasciare in loco potenziali focolai di diffusione neoplastica verso sedi organiche lontane da quella di origine. Due note importanti sull'argomento sono fornite dall'infrequente salto delle stazioni linfonodali nel cavo ascellare e dal costante coinvolgimento metastatico di livelli linfoghiandolari superiori quando sia positivo l'impegno di livelli inferiori; questo giustifica la ricerca del linfonodo sentinella, la cui negatività esime dall'esecuzione di una linfoadenectomia estesa con finalità terapeutica radicale. Per questi motivi - ed in considerazione della non incidenza della linfoadenectomia ascellare sulla sopravvivenza assoluta - non appare affatto ragionevole eseguire questa procedura dopo un accertamento istologico positivo su campioni di resezione mammaria. Infatti attualmente si dispone di assolutamente valide terapie alternative e/o complementari (radioterapia, chemioterapia, ormonoterapia); lo studio dei linfonodi asportati può indirizzare alla conoscenza del comportamento biologico della neoplasia piuttosto che assicurare una maggiore radicalità di trattamento; una linfoadenectomia in seconda istanza può essere riservata solo a pazienti non suscettibili di trattamenti adiuvanti sistemici.  |
 67.  |
 68.  |
 69.  |
BIBLIOGRAFIA
Arora N., King T.A., Jacks L.M., Stempel M.M., Patil S., Morris E., Morrow M. : Impact of breast density on the presenting features of malignancy. Ann. Surg. Oncol. 2010; Oct. 17 Suppl. 3, 211-8
Bartova M., Suska P., Pohlodek K. : Local recurrence rate in patients with DCIS. Bratisl. Lek. Listy. 2012; 113(1), 30-4
Bendifallah S., Werkoff G., Borie-Moutafoff C., Antoine M., Chopier J., Gligorov J., Uzan S., Coutant C., Rouzier R. : Multiple synchronous (multifocal and multicentric) breast cancer: clinical implications. Surg. Oncol. 2010; Dec. 19 (4), 115-23
Berry W.L., Shin S., Lightfoot S.A., Janknecht R. : Oncogenic features of the JMJD2A histone demethylase in breast cancer. Int. J. Oncol. 2012; Nov. 41 (5), 1701-6
Bisso A., Faleschini M., Zampa F., Capaci V., De Santa J., Santarpia L., Piazza S., Cappelletti V., Daidone M., Agami R., Del Sal G. : Oncogenic miR-181a/b affect the DNA damage response in aggressive breast cancer. Cell. Cycle 2013; Jun. 1, 12 (11), 1679-87
Chuthapisith S., Permsapaya W., Warnnissorn M., Akewanlop C., Sirivatanauksorn V., Prasarttong Osoth P. : Breast cancer subtypes identified by the ER, PR and HER-2 status in Thai women. Asian Pac. J. Cancer Prev. 2012; 13(2),459-62
Criscitiello C., Azim H.A. Jr., Agbor-tarh D., de Azambuja E., Piccart M., Baselga J., Eidtmann H., Di Cosimo S., Bradbury I., Rubio I.T. : Factors associated with surgical management following neoadjuvant therapy in patients with primary HER2-positive breast cancer: results from the NeoALTTO phase III trial. Ann. Oncol. 2013; Aug. 24(8), 1980-5
Duraker N., Caynak Z.C. : Axillary lymph node status and prognosis in multifocal and multicentric breast carcinoma. Breast J. 2014; Jan.-Feb.20(1), 61-8
Fisher B. : Role of science in the treatment of breast cancer when tumor multicentricity is present. J. Natl. Cancer Inst. 2011; Sep. 7, 103(17), 1292-8
Fitzsullivan E., Lari S.A., Smith B., Caudle A.S., Krishnamurthy S., Lucci A., Mittendorf E.A., Babiera G.V., Black D.M., Wagner J.L., Bedrosian I., Woodward W., Gainer S.M.,
Fortunato L., Mascaro A., Poccia I., Andrich R., Amini M., Costarelli L., Cortese G., Farina M., Vitelli C. : Lobular breast cancer: same survival and local control compared with ductal cancer, but should both be treated the same way? Analysis of an institutional database over a 10-year period. Ann. Surg. Oncol. 2012; Apr. 19(4), 1107-14
Gannon L.M., Cotter M.B., Quinn C.M. : The classification of invasive carcinoma of the breast. Expert Rev. Anticancer Ther. 2013; Aug. 13 (8), 941-54
Ghiasi N., Habibagahi M., Rosli R., Ghaderi A., Yusoff K., Hosseini A., Abdullah S., Jaberipour M. : Tumour suppressive effects of WEE1 gene silencing in breast cancer cells. Asian Pac. J. Cancer Prev. 2013; 14 (11), 6605-11
Grotenhuis B.A., Vrijland W.W., Klem T.M. : Radiofrequency ablation for early-stage breast cancer: treatment outcomes and practical considerations. Eur. J. Surg. Oncol. 2013; Dec. 39(12), 1317-24
Gurdal S.O., Ozcinar B., Kayahan M., Igci A., Tunaci M., Ozmen V., Acunas G., Yavuz E., Kecer M., Muslumanoglu M. : Incremental value of magnetic resonance imaging for breast surgery planning. Surg. Today 2013; Jan. 43(1), 55-61
Habashy H.O., Rakha E.A., Ellis I.O., Powe D.G. : The oestrogen receptor coactivator CARM1 has an oncogenic effect and is associated with poor prognosis in breast cancer. Breast Cancer Res. Treat. 2013; Jul. 140 (2), 307-16
Hwang R., Meric-Bernstam F., Hunt K.K., Kuerer H.M. : Incidence and consequence of close margins in patients with ductal carcinoma in situ treated with mastectomy: is further therapy warranted? Ann. Surg. Oncol. 2013; Dec.20(13), 4103-12
Kapoor N.S., Eaton A., King T.A., Patil S., Stempel M., Morris E., Brogi E., Morrow M. :
Should breast density influence patient selection for breast-conserving surgery? Ann. Surg. Oncol. 2013; Feb. 20(2), 600-6
Kim S.H., Cha E.S., Park C.S., Kang B.J., Whang I.Y., Lee A.W., Song B.J., Park J. : Imaging features of invasive lobular carcinoma: comparison with invasive ductal carcinoma. Jpn. J. Radiol. 2011; Aug. 29(7), 475-82
Kim R.G., Kim E.K., Kim H.A., Koh J.S., Kim M.S., Kim K.I., Lee J.I., Moon N.M., Ko E., Noh W.C. : Prognostic significance of molecular subtype in T1N0M0 breast cancer: Korean experience. Eur. J. Surg. Oncol. 2011; Jul. 37(7), 629-34
King T.A., Gurevich I., Sakr R., Patil S., Stempel M., Morrow M. : Occult malignancy in patients undergoing contralateral prophylactic mastectomy. Ann. Surg. 2011; Jul. 254(1), 2-7
Kósa C., Garami Z., Dinya T., Fülöp B. : Predictive factors of invasion with initial diagnosis of ductal carcinoma in situ based on core biopsy. Magy Seb. 2012; Aug. 65(4), 218-21
Jiang H., Zhao H., Xu H., Hu L., Wang W., Wei Y., Wang Y., Peng X., Zhou F. : Peripheral Blood Mitochondrial DNA Content, A10398G Polymorphism and Risk of Breast Cancer in Chinese Han Population. Cancer Sci. 2014; Apr. 7
Levrini G., Mori C.A., Vacondio R., Borasi G., Nicoli F. : MRI patterns of invasive lobular cancer: T1 and T2 features. Radiol. Med. 2008; Dec. 113 (8), 1110-25
Lynch S.P., Lei X., Chavez-MacGregor M., Hsu L., Meric-Bernstam F., Buchholz T.A., Zhang A., Hortobagyi G.N., Valero V., Gonzalez-Angulo A.M. : Multifocality and multicentricity in breast cancer and survival outcomes. Ann. Oncol. 2012; Dec. 23(12), 3063-9
Lynch S.P., Lei X., Hsu L., Meric-Bernstam F., Buchholz T.A., Zhang H., Hortobágyi G.N., Gonzalez-Angulo A.M., Valero V. : Breast cancer multifocality and multicentricity and locoregional recurrence. Oncologist 2013; 18(11), 1167-73
Lorgis V., Algros M.P., Villanueva C., Chaigneau L., Thierry-Vuillemin A., Nguyen T., Demarchi M., Bazan F., Sautiere J.L., Maisonnette-Lescot Y., Ringenbach F., Bontemps P., Pivot X. : Discordance in early breast cancer for tumour grade, estrogen receptor, progesteron receptors and human epidermal receptor-2 status between core needle biopsy and surgical excisional primary tumour. Breast 2011; Jun. 20(3), 284-7
McMahon S., Laframboise T. : Mutational patterns in the breast cancer mitochondrial genome, with clinical correlates. Carcinogenesis 2014; May 35 (5), 1046-1054
Michael M., Garzoli E., Reiner C.S. : Mammography, sonography and MRI for detection and characterization of invasive lobular carcinoma of the breast. Breast Dis. 2008-2009; 30, 21-30
Moo T.A., McMillan R., Lee M., Stempel M., Ho A., Patil S., El-Tamer M. : Impact of molecular subtype on locoregional recurrence in mastectomy patients with t1-t2 breast cancer and 1-3 positive lymph nodes. Ann. Surg. Oncol. 2014; May 21(5),1569-74
Moon H.G., Han W., Kim J.Y., Kim S.J., Yoon J.H., Oh S.J., Yu J.H., Noh D.Y. : Effect of multiple invasive foci on breast cancer outcomes according to the molecular subtypes: a report from the Korean Breast Cancer Society. Ann. Oncol. 2013; Sep. 24(9), 2298-304
Moutafoff C., Coutant C., Bézu C., Antoine M., Werkoff G., Benbara A., Uzan S., Rouzier R.: Prognostic and predictive factors in multifocal breast carcinoma. Gynecol. Obstet. Fertil. 2011; Jul.-Aug. 39 (7-8), 425-32
Neira P., Aguirre B., Taub T., Gutiérrez L., Sáez C., Ibarra A., Silva C. : Breast MRI--histologic correlation for ductal carcinoma in situ. Radiologia 2009; Jul.-Aug. 51 (4), 396-402
Oven Ustaalioglu B.B., Bilici A., Kefeli U., Seker M., Yildirim E., Salepci T., Oncel M., Kement M., Gumus M. : Does the metastatic lymph node ratio influence the disease-free survival of patients with breast cancer: single-center experiences. Oncology 2010; 79 (1-2), 105-11
Panousis D., Xepapadakis G., Lagoudianakis E., Karavitis G., Salemis N., Koronakis N., Patsouris E., Koronarchis D., Grosomanidis D., Chryssikos G., Ntasiou P., Kyriakidou V., Athanassiadou A.M., Athanassiadou P. : Prognostic value of EZH2, paxillin expression and DNA ploidy of breast adenocarcinoma: correlation to pathologic predictors. J. BUON. 2013; Oct.-Dec. 18 (4), 879-85
Peng Z., Weber J.C., Han Z., Shen R., Zhou W., Scott J.R., Chan M.W., Lin H.J. : Dichotomy effects of Akt signaling in breast cancer. Mol. Cancer. 2012; Aug. 24, 11:61
Pina Insausti L., Pons Renedo M.J. : Evaluation of the contralateral breast with magnetic resonance in patients with newly diagnosed unilateral breast cancer. Rev. Med. Univ. Navarra 2008; Jan.-Mar. 52 (1), 37-9
Pradella L.M., Evangelisti C., Ligorio C., Ceccarelli C., Neri I., Zuntini R., Amato L.B., Ferrari S., Martelli A.M., Gasparre G., Turchetti D. : A novel deleterious PTEN mutation in a patient with early-onset bilateral breast cancer. BMC Cancer 2014; Feb. 6, 14:70
Singh R., Gupta S., Pawar S.B., Pawar R.S., Gandham S.V., Prabhudesai S. : Evaluation of ER, PR and HER-2 receptor expression in breast cancer patients presenting to a semi-urban cancer centre in Western India. J. Cancer Res. Ther. 2014; Jan.-Mar. 10 (1), 26-8
Ustaalioglu B.O., Bilici A., Kefeli U., Şeker M., Oncel M., Gezen C., Gumus M., Demirelli F. :
The importance of multifocal/multicentric tumor on the disease-free survival of breast cancer patients: single center experience. Am. J. Clin. Oncol. 2012; Dec. 35(6), 580-6
Veiseh M., Kwon D.H., Borowsky A.D., Tolg C., Leong H.S., Lewis J.D., Turley E.A., Bissell M.J. : Cellular heterogeneity profiling by hyaluronan probes reveals an invasive but slow-growing breast tumor subset. Proc. Natl. Acad. Sci. U.S.A. 2014; Apr. 29, 111
Verma S., Salmans M.L., Geyfman M., Wang H., Yu Z., Lu Z., Zhao F., Lipkin S.M., Andersen B. : The estrogen-responsive Agr2 gene regulates mammary epithelial proliferation and facilitates lobuloalveolar development. Dev. Biol. 2012; Sep. 15, 369 (2), 249-60
Vtorushin S.V., Zab'ialova M.V., Glushchenko S.A., Perel'muter V.M., Slonimskaia E.M. : Occult multicentric breast cancer. Vopr. Onkol. 2009; 55 (1), 38-41



