Chirurgia della Mammella (4/4)
- Dettagli
- Categoria: Lezioni
- Pubblicato Martedì, 12 Agosto 2014 15:18
- Scritto da Paolo Purri
- Visite: 10685
|
|
 |
02.  |
|
|
 04.  OPZIONI TERAPEUTICHE (diapositive 5-9) Il programma terapeutico pone al primo posto il trattamento chirurgico, modulato in riferimento alle caratteristiche biologiche della neoplasia ed allo stadio clinico della malattia. La scelta tra le varie opzioni spazia da resezioni più o meno estese (diapositiva 5) ad aggressioni limitate (diapositiva 6); in caso di quest'ultima scelta è imperativa la radiosterilizzazione del residuo mammario associata alla dissezione linfonodale ascellare. In merito a questa è necessaria la conoscenza della distribuzione delle unità linfonodali, raggruppate in tre livelli anatomicamente ben definiti (diapositiva 7), così che l'escissione può essere modulata in base al "grading istologico" ed all'aggressività biologica della neoplasia, oltre che allo stadio clinico della patologia. E questo sia con finalità strettamente terapeutica che predittiva in quanto la positività istologica non stabilisce certezza di successiva diffusione metastatica ma fornisce indicazioni sulla possibile evoluzione della malattia. Senza entrare nel merito di dettagli tecnici delle diverse procedure chirurgiche, analizziamo le caratteristiche distintive di ognuna di esse al fine di facilitare la comprensione dei parametri anatomo-clinici che condizionano la scelta dell'una piuttosto che dell'altra.  |
 |
05.  |
 06.  |
 |
07.  |
 08.  |
 |
09.  MASTECTOMIA RADICALE MODIFICATA sec. Patey Consiste nell'ablazione completa della mammella unitamente alla dissezione linfonodale ascellare con conservazione del muscolo grande pettorale; il muscolo piccolo pettorale viene asportato (per facilitare la linfoadenectomia nell'apice dell'ascella) o semplicemente dislocato (per consentire una accurata exeresi dei linfonodi di Rotter). E' riservata a casi inquadrati nel I, II e III stadio, senza fissità della lesione al muscolo pettorale e massivo coinvolgimento linfonodale ascellare (che suggerisce, invece, l'opportunità di una mastectomia radicale estesa). Il risultato cosmetico è certamente migliore rispetto a quello conseguito con la mastectomia radicale sec. Halsted; infatti l'incisione trasversale (e non a racchetta) oltre ad offrire maggiori opportunità di abbigliamento consente modalità di ricostruzione che non richiedono l'utilizzo di flaps muscolo-cutanei. La tecnica modificata permette, altresì, una pari estensione ed efficacia della linfoadenectomia ascellare e fornisce sovrapponibili indici di sopravvivenza e solo modeste differenze nelle frequenze di recidive nei soggetti operati al III stadio di malattia. Lo stesso vale per l'intervallo libero da malattia, simile per entrambe le procedure. La fascia del muscolo pettorale costituisce una valida barriera alla diffusione in profondità del tumore; l'eventuale suo interessamento consiglia l'opportunità di asportare un cuneo muscolare in corrispondenza della zona di infiltrazione.  |
 |
10.  MASTECTOMIA RADICALE ALLARGATA Si differenzia dalla precedente per l'estensione della linfoadenectomia ai linfonodi lungo l'arteria mammaria interna ed è indicata per il trattamento di lesioni nei quadranti interni della mammella. L'analisi comparativa dei risultati ottenuti con questa procedura piuttosto che con quella precedentemente descritta dimostra assoluta sovrapponibilità degli indici di sopravvivenza sia in caso di positività dei linfonodi mammari accompagnata da negatività di quelli ascellari che in caso di riscontri di positività invertita; differenze dei tassi di sopravvivenza sono evidenti invece nella comparazione dei risultati per trattamento di lesioni nei quadranti interni della ghiandola.  |
 |
11.  MASTECTOMIA TOTALE Consiste nell'ablazione dell'intero tessuto ghiandolare mammario (compresa l'areola), con risparmio dei muscoli pettorali e delle stazioni linfonodali ascellari. Questa tecnica è riservata come prima scelta al trattamento delle neoplasie in situ, sia del tipo duttale che lobulare, per le quali è risaputo che il coinvolgimento linfonodale ascellare è inferiore allo 1% dei casi. In seconda istanza, invece, è impiegata con scopi profilattici (specie sulla mammella controlaterale di soggetti ad alto rischio o nel sospetto di multicentricità non sintomatica); o nelle recidive dopo mastectomia con svuotamento ascellare, in assenza di metastasi ed indipendentemente dall'eventuale radiobonifica del residuo mammario. In presenza di metastasi l'utilizzo in seconda istanza ha unicamente finalità palliativa.  |
 12.  MASTECTOMIA SOTTOCUTANEA E' riservata ad intendimenti profilattici e cosmetici in quanto contempla la rimozione della maggior parte della ghiandola mammaria con risparmio del capezzolo e dell'areola; ma lo scarso utilizzo è legato all'obiettività di effetti estetici non esaltanti. La metodica non è scevra, inoltre, da rischi di incompletezza di trattamento in quanto una percentuale variabile tra il 10% ed il 15% del tumore profondamente indovato potrebbe involontariamente non essere compresa nell'exeresi e costituire una possibile area di sviluppo successivo della neoplasia.  |
 |
13.  RICOSTRUZIONE DOPO MASTECTOMIA (diapositive 14-17) Sotto il profilo psicologico la menomazione chirurgica incide fortemente sulla vita di relazione della donna; per questo motivo le tecniche di ricostruzione post-mastectomia occupano uno spazio non trascurabile nel piano terapeutico delle neoplasie mammarie. Esiste una certa flessibilità sul "timing" della ricostruzione: in contemporanea con l'ablazione della lesione o differita di 3-6 mesi . Nel primo caso è più alto il rischio di complicazioni locali (infezione, deiscenza ed espulsione della protesi, etc.), mentre nel secondo crescono le garanzie di successo per la stabilizzazione dell'apporto ematico alla cute ed ai tessuti molli che circoscrivono l'impianto protesico. Quanto al rischio di recidiva locale, non vi è alcuna prova che questo risulti più elevato nei soggetti così trattati, nè che sia più difficoltosa l'identificazione di una eventuale recidiva in presenza di protesi ricostruttiva. Una nota particolare merita la rarità di recidive a carico della parete toracica in casi di neoplasie senza coinvolgimento linfonodale ascellare; per questo motivo attualmente non si considera più questo parametro una discriminante nella selezione di pazienti candidate alla ricostruzione mammaria. La selezione tra le diverse tecniche di ricostruzione tiene conto della entità e lassità del lembo cutaneo che riveste la parete toracica, della conservazione dell'innervazione del muscolo grande pettorale, della morfologia della mammella controlaterale. Ove possibile, si ricorre ad un impianto di materiale inorganico, fisso (silicone) o modulabile (poliuretano); in caso di rivestimento cutaneo sottile e scarsamente elastico o di ablazione del m. pettorale si dovrà ricorrere all'applicazione preliminare di espansori o alla preparazione di flaps miocutanei peduncolizzati (m. latissimo del dorso) o trasposti (muscolo grande gluteo). Un problema a sè è la ricostruzione del capezzolo e dell'areola in quanto la preservazione di queste strutture - ottimale ai fini cosmetici - espone ad alto rischio di recidive locali per la possibilità di foci neoplastici profondi non coinvolti nell'exeresi con tecnica ablativa sottocutanea: per questo motivo si dovrà ricorrere a tecniche di chirurgia plastica, con utilizzo di impianto delle piccole labbra vulvari o lembi cutanei prelevati dalla faccia interna delle cosce (dove la pigmentazione è più marcata). Assai meno diffusa è la realizzazione di un tatuaggio (simulazione dermografica) o di una sutura cutanea a borsa di tabacco. Quale che sia la tecnica adottata, non sono rare le complicazioni connesse con le ricostruzioni mammarie: dall'ematoma alla flogosi, dall'ischemia dei tessuti molli all'espulsione della protesi: l'entità delle complicazioni è certamente aggravata da eventuali pregressi trattamenti radianti, tanto da richiedere riparazioni con flaps miocutanei o la rimozione della protesi stessa in caso di formazione di una capsula fibrosa intorno ad essa.  |
 14.  |
 |
15.  |
 |
16.  |
 |
17.  TRATTAMENTO DI LESIONI "IN SITU" (diapositive 18-22) Lo scopo primario del trattamento delle lesioni neoplastiche è eradicare il tumore e controllarne la diffusione locale, con l'ulteriore obiettivo di assicurare i più elevati indici di sopravvivenza possibili. Un siffatto programma impegnativo non può prescindere da valutazioni che tengano conto dell'età del soggetto affetto e dello stadio della patologia al momento dell'approccio terapeutico. Per questi motivi è imperativo separare le lesioni precoci dalle forme già avanzate, dal momento che le prime possono giovarsi di trattamenti più conservativi; anche se la maggiore spettanza di vita nei soggetti giovani espone a maggiori rischi di recidiva neoplastica con maggiori richieste di terapie di salvataggio, ancorchè attuabili. Nell'ottica di queste premesse si comprende come un piano strategico terapeutico per un carcinoma "in situ" sia sostanzialmente diverso da quello per una forma "avanzata", per i motivi di seguito riportati. Esistono due forme di carcinoma mammario in situ: duttale (DCIS) e lobulare (LCIS): il primo, altrimenti definito "intraduttale" o "duttale non invasivo", è caratterizzato da una proliferazione cellulare epiteliale maligna rigidamente confinata entro le pareti dei dotti ghiandolari, senza alcun segno di interessamento dello stroma circostante per superamento della membrana basale. La sua identificazione è il più delle volte accidentale, in corso di esame istologico di tessuti ghiandolari interessati da patologie benigne (fibroadenomi o mastopatie fibrocistiche); altre volte piccoli focolai neoplastici sono rinvenuti nel contesto di aree mammarie ritenute sospette alla palpazione o all'indagine mammografica. Anche se la progressione verso una forma avanzata non è provata con certezza, il suo frequente riscontro nella mammella controlaterale a quella in cui è localizzata una forma neoplastica avanzata condiziona le scelte terapeutiche tese a garantire un risultato ottimale. Tra le tre possibili opzioni terapeutiche - mastectomia, escissione del tumore e radioterapia, semplice escissione della lesione - la prima è preferibile sia per la frequente coesistenza di un DCIS con lesioni neoplastiche invasive sia per la possibile multifocalità del tumore; inoltre garantisce una sopravvivenza pressochè totale ed il pieno controllo dello sviluppo locale della patologia. E' controversa la necessità di una linfoadenectomia ascellare associata alla mastectomia, e comunque limitata al I livello e solo per lesioni estese; mentre non trova indicazione per tumori di dimensioni contenute. L'escissione locale del tumore, seguita da radiobonifica del tessuto mammario residuo, è riservata ai casi di accertata assenza di interessamento linfonodale, mentre la semplice ablazione del tumore è appannaggio di lesioni di proporzioni molto modeste. L'impiego di queste procedure più conservative è giustificato anche dalla documentata efficacia delle terapie di salvataggio dopo una eventuale recidiva locale: queste vanno dalla mastectomia dopo escissione del tumore e radiobonifica alla mastectomia o escissione più ampia e radiobonifica dopo una semplice enucleoresezione. Imperativo categorico, in tutti i casi, è un rigoroso follow-up con esame clinico e mammografia almeno ogni 4-6 mesi dal trattamento primario. Altra forma di neoplasia "in situ" è il carcinoma lobulare (LCIS), una neoplasia che origina dalle aree periferiche dei lobuli ghiandolari e che spesso si sviluppa nel contesto di una lesione avanzata, sia lobulare che duttale. La sua identificazione con semplice esame clinico è quasi impossibile, rendendo la neoplasia particolarmente subdola sotto il profilo diagnostico; l'obiettività più frequente è infatti sovrapponibile a quella di una mastopatia fibrocistica, con la quale peraltro non sussistono relazioni di sorta: un'area non ben definita di aumentata consistenza della ghiandola mammaria che di per sè non presenta i connotati del rischio neoplastico. Il quadro microscopico si avvicina molto a quello dell'iperplasia lobulare benigna, con le stesse difficoltà di diagnosi differenziale incontrate tra il carcinoma intraduttale e le lesioni proliferative o iperplastiche mammarie; da qui la definizione da molti adottata di "iperplasia lobulare atipica". Anche se non provata, una progressione verso la forma infiltrante è da molti sostenuta, secondo percentuali crescenti negli anni, con un "range" variabile tra il 10% a 5 aa. ed il 30% a 15 anni dal trattamento primario conservativo (per evoluzione di focolai IS profondamente indovati e non compresi nell'exeresi); tale fenomeno è del tutto sovrapponibile a quello già citato a proposito del DCIS. Per questi motivi - e per la tutt'altro che infrequente multifocalità, apprezzabile in percentuali comprese tra 15% e 25% in soggetti con storia familiare positiva per carcinoma mammario - l'opzione terapeutica più accreditata è la mastectomia ipsilaterale associata ad una resezione parziale controlaterale; in contrasto con opzioni più conservative (exeresi locali associate a follow-up rigoroso) o più estensive (mastectomia bilaterale e ricostruzione protesica per soggetti a rischio elevato per storia familiare marcatamente positiva). La radioterapia sembra non avere alcun ruolo nel trattamento del carcinoma lobulare in situ.  |
 |
18.  |
 |
19.  |
 20.  |
 21.  |
 22.  TRATTAMENTO DEL CA. AL III STADIO (diapositive 23-25) Il carcinoma localmente avanzato (III stadio) è caratterizzato da una lesione neoplastica con impegno linfonodale in assenza di documentate metastasi. Il solo trattamento chirurgico si dimostra insufficiente sul piano terapeutico, mentre è elevata l'incidenza di recidive e limitata la sopravvivenza, con conseguente scarsa prognosi. Dal punto di vista clinico la neoplasia è etichettata in base a 5 grandi segni semeiologici, variamente combinati tra loro: edema della cute sovrastante la lesione, frequenti ulcerazioni, fissità alla parete toracica, dimensioni pari o superiori a 2,5 cm. dei linfonodi ascellari con fissità tra loro. L'alta frequenza di recidive locali suggerisce l'utilizzo in combinazione di chirurgia e radioterapia (a dosi maggiori di quelle impiegate per lesioni in stadi inferiori); la procedura chirurgica di scelta è la mastectomia che, unitamente alla radioterapia, è in grado di controllare l'evoluzione locale del tumore ma espone ad una maggiore incidenza di edema dell'arto superiore omolaterale. Tale approccio terapeutico viene completato con chemioterapia adiuvante, alla quale è demandato il miglioramento dell'intervallo libero da malattia e degli indici globali di sopravvivenza (che tuttavia ben difficilmente superano l'arco di 5 anni dall'inizio del trattamento). Una pianificazione modulata dell'iter terapeutico affida alla sola mastectomia (la cui estensione è riferita alle dimensioni del tumore) il trattamento delle lesioni senza coinvolgimento linfonodale, associando la radioterapia in presenza di fissità dei linfonodi ascellari interessati e la chemioterapia nei casi in cui siano coinvolti anche linfonodi sovra- e sotto-claveari.  |
 23.  |
 24.  |
 25.  LA MALATTIA DI PAGET DEL CAPEZZOLO (diapositive 26-27) Sotto l'aspetto macroscopico la patologia è caratterizzata da una eruzione eczematoide pruriginosa del capezzolo, sostenuta microscopicamente dall'infiltrazione nell'epidermide di larghe cellule con citoplasma chiaro e nuclei irregolari (cellule di Paget). L'evidenza clinica più frequente (60% dei casi) è quella della presenza di una massa palpabile nel contesto della mammella, spesso lontano dall'area areolare; l'interessamento del capezzolo può essere la conseguenza della migrazione in esso di cellule maligne dalla lesione carcinomatosa sottostante o risultare totalmente indipendente. Evidentemente la prognosi è unicamente riferita alle caratteristiche della coesistente massa neoplastica, risultando ovviamente eccellente in caso di assenza di una lesione carcinomatosa più o meno profonda. Un coinvolgimento linfoghiandolare ascellare si registrata nella metà circa dei casi ed in presenza di una lesione neoplastica. Il trattamento è condizionato dalla sussistenza o meno della neoplasia, spaziando - rispettivamente - tra una mastectomia radicale con svuotamento ascellare ed una mastectomia totale; procedure chirurgiche più conservative, con o senza radioterapia associata, trovano riscontro nel fatto che risulta comunque bassa l'incidenza di recidive locali dopo siffatte procedure terapeutiche.  |
 26.  |
 27.  CARCINOMA MAMMARIO NEL MASCHIO (diapositive 28-31) Lesione decisamente poco frequente in assoluto (1% dei casi rispetto ai soggetti di sesso femminile), dimostra un'insorgenza nettamente più tardiva (circa 10 anni) rispetto al carcinoma nelle donne. E' bassa la distribuzione familiare, con indici in crescita nelle famiglie con alta incidenza di carcinoma mammario tra le donne. La patologia è associata con malattie che generano iperestrinismo: ne è un esempio la bilarziosi, particolarmente frequente in Egitto, capace di indurre danno epatico cui conseguono elevati valori ematici di estrogeno, all'origine della ginecomastia e successivamente del cancro mammario (6%). Stesso discorso vale per il rapporto riconosciuto tra sindrome di Klinefelter e cancro. Tutte le forme neoplastiche sono possibili, fatta eccezione per il carcinoma lobulare in situ (LCIS); così come alta risulta la percentuale di positività recettoriale del tumore (85% dei casi). Generalmente monolaterale, per la scarsità di tessuto ghiandolare frequentemente mostra adesione e/o infiltrazione del sottostante muscolo grande pettorale; oltre ad irregolarità del profilo del capezzolo, secrezione dallo stesso ed ulcerazioni del piano tegumentario. La scelta terapeutica cade sulla mastectomia radicale in ragione del frequente coinvolgimento del piano muscolare pettorale; l'associazione di radioterapia pre- o post-operatoria si giustifica negli stadi più avanzati della malattia. Sotto il profilo prognostico il coinvolgimento linfonodale non mostra sostanziali differenze rispetto alla medesima situazione nei soggetti di sesso femminile, anche se non è infrequente una peggiore predittività di sopravvivenza nei pazienti di sesso maschile. Anche la diffusione metastatica appare sovrapponibile nei due sessi, con pari distribuzione per i tessuti molli (60%) e per le strutture ossee (50%). Il trattamento standard per le metastasi è la orchiectomia, con risultati migliori rispetto alla ooforectomia nelle donne in ragione della elevata presenza di ER circolante; opzione terapeutica successiva, in caso di insuccesso o di ripresa di malattia, è l'ipofisectomia o l'impiego di antiestrogeni nell'intento di risparmiare al paziente il ricorso a procedure chirurgiche particolarmente aggressive. Utile si dimostra, altresì, la chemioterapia secondo schemi classici già in uso e con successo nella patologia appannaggio di pazienti di sesso femminile.  |
 28.  |
 29.  |
 30.  |
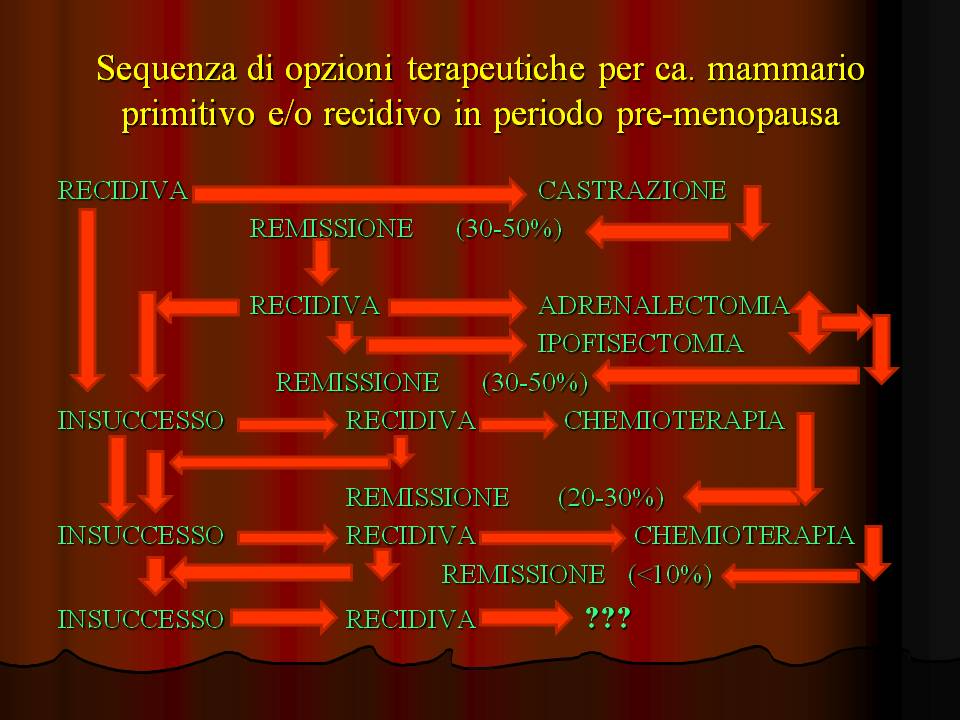
 31.  IL TRATTAMENTO DELLE METASTASI (diapositive 32-34) Una recidiva neoplastica, singola o multifocale, sia che interessi la parete toracica che il fegato o altri visceri, determina una condizione di incurabilità, con una sopravvivenza media - a dispetto dei piani terapeutici messi in opera - non oltre due anni dall'esordio, . Tra le varie opzioni terapeutiche cosiddette di salvataggio la chirurgia è preferibile per fini ablativi di lesioni secondarie uniche o per interventi su ghiandole endocrine attive nello sviluppo e progressione della neoplasia; mentre la radioterapia - da sola o combinata con altre metodiche terapeutiche - appare più indicata per lesioni concentrate in un organo o apparato difficilmente accessibile chirurgicamente se non con elevato rischio locale e generale per l'ospite. In caso di lesioni multifocali, specie viscerali, non v'è dubbio che la scelta debba cadere su terapie sistemiche (ormonale o chemio). Sulla valutazione dell'efficacia dei trattamenti di salvataggio molto incide l'intervallo libero da malattia dopo il primo trattamento, essendo la sopravvivenza media direttamente proporzionale al tempo intercorso in assenza di manifestazioni cliniche riferibili al tumore; lo stesso vale, in particolare, per la predittività di responsività al trattamento ormonale nelle neoplasie con positività recettoriale, per le quali la maggiore efficacia è attendibile nei casi di comparsa di metastasi oltre due anni dal primo intervento terapeutico. E' importante tenere presente che gli indici prognostici delle singole forme neoplastiche in relazione allo stadio clinico della malattia non condizionano la scelta tra le varie opportunità terapeutiche di salvataggio; ovviamente è maggiore la percentuale di successo - sia pure parziale - quanto più precoce è l'identificazione di un focolaio unico o multiplo di ripresa di malattia: allo scopo tornano estremamente utili i controlli strumentali e bioumorali (diapositiva 34) eseguiti con cadenze trimestrali nei primi due anni e semestrali nei successivi tre.  |
 32.  |
 33.  |
 34.  TERAPIA ORMONALE (diapositive 35-42) Il carcinoma mammario è uno dei pochi tumori altamente responsivi alla terapia ormonale, con un meccanismo di azione che fa riferimento alla caratteristica di crescita delle neoplasie per l'azione degli ormoni della sfera genitale femminile, particolarmente dell'estrogeno; e' noto, infatti, che alcune linee cellulari neoplastiche secernono fattori di crescita (TGF) sotto il controllo dell'estrogeno mediato dai recettori estrogenici (se presenti) o indipendentemente da questi (se assenti). L'azione di questi fattori di crescita si esplica sulle stesse cellule che li hanno prodotti (stimolazione autocrina) o sulle cellule confinanti (stimolazione paracrina). Questo spiega come mai la distruzione di un esiguo numero di cellule neoplastiche estrogeno-dipendenti possa incidere su una gran massa di cellule neoplastiche estrogeno-indipendenti: caratteristica che viene sfruttata in chiave terapeutica con l'impiego di antiestrogeni anche per tumori ER-negativi. Aldilà dei criteri di scelta del trattamento ormonale più indicato per singolo caso - caratteristiche della malattia, protocolli terapeutici pregressi, presenza di recettori specifici cellulari e stato menopausale - gli obiettivi della ormonoterapia sono essenzialmente tre : * impedire alla cellula neoplastica di essere influenzata dall'azione dell'estrogeno endogeno (mediante somministrazione di anti-estrogeni); * inibire la produzione di estrogeno bloccando la trasformazione di androgeni ad opera dell'enzima aromatasi (mediante somministrazione di inibitori dell'aromatasi); * inibire la produzione estrogenica dalle ovaia (mediante somministrazione di analoghi di LH-RH). Sono disponibili, dunque, tre classi di farmaci con caratteristiche precipue che ne regolano la scelta a seconda delle forme neoplastiche e dello stato fisiologico dell'ospite. Gli antiestrogeni - di cui il tamoxifene è il più largamente impiegato - esercitano la loro azione impedendo all'estrogeno di combinarsi con i siti recettoriali cellulari, disinnescando così il circuito che conduce alla crescita neoplastica. Attivi sia in fase pre- che post-menopausa, possono esporre al rischio di cancro dell'endometrio, trombosi degli arti inferiori ed isctus cerebrale; ma gli effetti benefici si dimostrano largamente superiori ai rischi appena enunciati. Gli inibitori dell'aromatasi sono riservati a soggetti già in menopausa in quanto esplicano la loro azione riducendo la quantità di estrogeno circolante ed impedendo la conversione dagli androgeni nel tessuto muscolare, nel fegato e nel tessuto adiposo. Non sono gravati dagli stessi effetti collaterali indesiderati riscontrati per gli antiestrogeni, ma il loro impiego prolungato può determinare osteoporosi. Gli analoghi del LH-RH (ormone ipotalamico che stimola la produzione adenoipofisaria di LH e FSH) esercitano la loro funzione con meccanismo transitorio di soppressione ovarica, e pertanto sono indicati in periodo pre-menopausa. Dopo una prima breve fase di stimolazione dell'adenoipofisi alla produzione degli ormoni gonadostimolanti, la loro somministrazione esercita una funzione di blocco sulla secrezione ipofisaria degli ormoni che agiscono sulle ovaia determinando una interruzione della produzione estrogenica ed una amenorrea transitoria ipogonadotropa. L'effetto di blocco della crescita neoplastica estrogeno-mediata è massimale per la combinazione con antiestrogeni per un periodo di almeno due anni.  |
 35.  |
 36.  |
 37.  |
 38.  |
 39.  |
 40.  |
 41.  |
 42.  TERAPIA BIOLOGICA (diapositiva 43) Si avvale dell'utilizzo di anticorpi monoclonali, così definiti perchè provenienti da un solo tipo di cellula immunitaria (clone cellulare); sono anticorpi in grado di legare un determinante antigenico (epitopo), una proteina (target molecolare) presente sulle cellule tumorali o nel sangue circolante dei pazienti affetti dalla neoplasia, realizzando effetti curativi e salvaguardando nel contempo la qualità di vita dell'individuo trattato. L'applicazione nel trattamento delle neoplasie mammarie sensibili mira a perseguire due possibili obiettivi: impedire la crescita delle cellule tumorali e/o colpire l'angiogenesi del tessuto neoplastico interrompendo il rifornimento di sangue che è essenziale per la sopravvivenza e la diffusione del tumore. Farmaci rispondenti alla prima finalità - di cui il più diffuso è l'Herceptin - si utilizzano nel trattamento di tumori che presentano elevate quantità di una proteina specifica (HER2) sulla membrana delle cellule tumorali (25%), di cui regolano la crescita e la progressione; la finalità del trattamento varia in relazione allo stadio della patologia: * in fase iniziale, ridurre il rischio di ripresa della malattia; * in fase localmente avanzata, ridurre l'estensione locale migliorando l'operabilità e la prognosi; * in fase metastatica, controllare l'evoluzione (generalmente in combinazione con la chemioterapia). Farmaci atti, invece, al perseguimento del secondo obiettivo - il più noto dei quali è l'Avastin - sono impiegati nei casi in cui è scarsa la positività di HER2 ma elevata quella di VEGF (fattore di crescita endoteliale vascolare), specie nelle fasi avanzate della patologia ed in presenza di metastasi, con lo scopo di impedire o quanto meno di limitare la progressione della lesione. I risultati di questa terapia sono decisamente soddisfacenti per la riduzione del rischio di recidiva dopo trattamento chirurgico, meno negli stadi avanzati di neoplasie già diffuse ad altri organi.  |
 43.  CHEMIOTERAPIA (diapositive 44-47) Il piano terapeutico di un carcinoma mammario contempla la chemioterapia, sia a completamento dell'approccio primario che a salvataggio di situazioni evolutive che si presentano nell'arco dell'iter clinico della malattia. L'efficacia dei protocolli si mostra elevata al primo trattamento (oltre il 65% di risposte positive), ma la completa eradicazione della condizione patologica è sensibilmente inferiore (intorno al 20%). Mediamente l'efficacia del risultato approssima la durata di un anno dal trattamento e la sopravvivenza dopo il primo ciclo di terapia supera l'arco di tre anni; l'intervallo libero da malattia mostra una consistente variabilità, con un range compreso tra 5 e 10 anni nei pazienti con elevata responsività dopo il primo trattamento. La persistenza di sintomatologia specifica in conseguenza della scarsa o assente risposta clinica alla ormonoterapia è uno dei parametri presi in considerazione per il ricorso al trattamento chemioterapico; l'intervallo libero da malattia misura l'efficacia del protocollo applicato e nel contempo garantisce sulla sua durata, che comprensibilmente è inversamente proporzionale al numero di focolai metastatici presenti all'atto del trattamento. In presenza di progressione della malattia nel corso del primo ciclo di terapia praticata vi è scarsa garanzia di un maggiore successo ricorrendo a protocolli terapeutici diversi. I criteri di responsività indicano livelli più elevati nei tumori a più rapida crescita, evidenziata da un elevato indice mitotico e di timidin-chinasi (il cui incremento accompagna la fase di crescita cellulare). La risposta al trattamento chemioterapico è particolarmente evidente per linee cellulari con tempi di raddoppio brevi ed assenza di positività recettoriale per l'estrogeno; anche se lo stato recettoriale estrogenico non è determinante per la selezione dei pazienti chemioresponsivi. Quanto ad un secondo ed un terzo ciclo di trattamento chemioterapico - cosiddetto di salvataggio - la probabilità di successo oscilla tra il 20% ed il 35%, in dipendenza anche dai farmaci impiegati in prima istanza (con livelli superiori se comprensivi della adriamicina); un intervallo libero da malattia di almeno sei mesi in cui il soggetto non è sottoposto ad alcun trattamento fornisce maggiori prospettive di risposta positiva alla terapia di salvataggio - anche se con gli stessi farmaci precedentemente impiegati - ed una sopravvivenza media ulteriore variabile tra 6 e 18 mesi. Nell'intento di migliorare gli effetti terapeutici si è dato spazio alla combinazione chemioterapia-ormonoterapia, basandosi sull'ipotesi - non del tutto suffragata - dell'esistenza di due distinti cloni cellulari: l'uno responsivo alla chemioterapia ma resistente all'ormonoterapia, l'altro dalle caratteristiche esattamente contrarie; di fatto detta combinazione dimostra una maggiore efficacia clinica ma non una più elevata sopravvivenza dei soggetti così trattati.  |
 44.  |
 45.  |
 46.  |
 47.  ALTRE OPZIONI TERAPEUTICHE (diapositive 48-50) Nelle fasi più avanzate della malattia, quando sono evidenti localizzazioni metastatiche ossee e/o viscerali, sono utilizzabili altre opzioni terapeutiche rappresentate dalla radioterapia, dalla terapia fotodinamica, dall'ipertermia e dalla laserterapia superficiale. Fra queste la radioterapia trova maggiore spazio di utilizzo, sia nel programma di bonifica del residuo mammario o della ghiandola controlaterale a quella chirurgicamente trattata, sia per l'aggressione di localizzazioni metastatiche a carico della parete toracica. Tuttavia i risultati non sono duraturi nel tempo, essendo documentata una risposta iniziale tra 60% e 80% seguita da una percentuale di recidive locali compresa tra il 35% ed il 65% dei casi, con esposizioni a dosi anche elevate, a seconda dei casi. Al momento si può stabilire un protocollo di utilizzo della radioterapia come succedaneo della terapia sistemica per le recidive locali particolarmente sintomatiche, o come unica alternativa a questa nei casi di insuccesso. La terapia fotodinamica sfrutta la fotosensibilità delle porfirine e il caratteristico accumulo selettivo di queste nelle cellule neoplastiche. L'esposizione alla luce rossa attiva dette porfirine all'interno del tumore e queste trasferiscono l'energia all'ossigeno intracellulare danneggiando i tessuti circostanti. Gli esperimenti di Dougherty hanno aperto un campo di applicazioni inizialmente rivoluzionario, ma successivamente fortemente mitigato dalla mole di effetti collaterali legati all'affinità delle porfirine per tutti i tessuti in rapida proliferazione, tra cui la cute (con possibili ustioni ed eritemi solari). L'ipertermia - da sola o in combinazione con la radioterapia e con la chemioterapia - trova applicazioni sempre più limitate per i bassi indici di successo terapeutico e la scarsa durata temporale; lo stesso vale per le applicazioni del laser di superficie - specie intraoperatorio - cui si fa preferire decisamente l'escissione chirurgica tradizionale. In sintesi il bagaglio di procedure terapeutiche disponibili per il trattamento delle neoplasie mammarie offre una vasta gamma di opportunità atte ad affrontare le varie fasi della malattia nel rispetto dello stadio clinico e delle caratteristiche proprie della lesione; esperienze e conoscenze fin qui acquisite hanno consentito il raggiungimento degli attuali risultati sia in tema di curabilità che di qualità di vita residua.  |
 48.  |
 49.  |
 50.  |
BIBLIOGRAFIA
Ballard T.N., Momoh A.O. : Advances in breast reconstruction of mastectomy and lumpectomy defects. Surg. Oncol. Clin. N. Am. 2014; Jul. 23 (3), 525-548
Capobianco G., Simbula L., Soro D., Meloni F., Cossu-Rocca P., Dessole S., Ambrosini G., Cherchi P.L., Meloni G.B. : Management of breast lobular carcinoma in situ: radio-pathological correlation, clinical implications, and follow-up. Eur. J. Gynaecol. Oncol. 2014; 35 (2), 157-62
Cheng H., Bai Y., Sikov W., Sinclair N., Bossuyt V., Abu-Khalaf M.M., Harris L.N., Rimm D.L. : Quantitative measurements of HER2 and phospho-HER2 expression: correlation with pathologic response to neoadjuvant chemotherapy and trastuzumab. BMC Cancer 2014; May 14 (1), 326
Cotlar A.M., Dubose J.J., Rose D.M. : History of surgery for breast cancer: radical to the sublime.
Curr. Surg. 2003; May -Jun. 60 (3), 329-37
Dent B.L., Small K., Swistel A., Talmor M. : Nipple-areolar complex ischemia after nipple-sparing mastectomy with immediate implant-based reconstruction: risk factors and the success of conservative treatment. Aesthet. Surg. J. 2014; May 34 (4), 560-70
de Perrot M., Deléaval J., Robert J., Spiliopoulos A. : Thirty-year experience of surgery for breast carcinoma in men. Eur. J. Surg. 2000; Dec. 166 (12), 929-31
Di Lascio S., Pagani O. : Oligometastatic Breast Cancer: A Shift from Palliative to Potentially Curative Treatment? Breast Care (Basel) 2014; Feb. 9 (1), 7-14
Elsberger B., Roxburgh C.S., Horgan P.G. : Is there a role for surgical resections of hepatic breast cancer metastases? Hepatogastroenterology 2014 ; Jan.-Feb. 61 (129), 181-6
Fisher B., Jeong J.H., Anderson S., Bryant J., Fisher E.R., Wolmark N. : Twenty-five-year follow-up of a randomized trial comparing radical mastectomy, total mastectomy, and total mastectomy followed by irradiation. N. Engl. J. Med. 2002; Aug. 22; 347 (8), 567-75
Fisher B. : Role of science in the treatment of breast cancer when tumor multicentricity is present.
J. Natl. Cancer Inst. 2011; Sep. 103 (17), 1292-8
Ghossain A., Ghossain M.A. : History of mastectomy before and after Halsted. J. Med. Liban. 2009; Apr.-Jun. 57 (2), 65-71
Hanagiri T., Nozoe T., Yoshimatsu T., Mizukami M., Ichiki Y., Sugaya M., Yasuda M., Takenoyama M., Sugio K., Yasuda H., Yasumoto K. : Surgical treatment for chest wall invasion due to the local recurrence of breast cancer. Breast Cancer 2008;15 (4), 298-302
Inafuku K., Inari H., Goto N., Kawamoto M., Hatori S., Tanabe H., Masuda M. : A case of postmenopausal breast cancer becoming HER2 positive after neoadjuvant hormone therapy. Gan To Kagaku Ryoho 2014; Apr. 41 (4), 487-9
MacDermed D.M., Houtman K.M., Thang S.H., Allen P.K., Caudle A.S., Gainer S.M., Hunt K.K., Perkins G.H., Shaitelman S.F., Smith B.D., Strom E.A., Tereffe W., Woodward W.A., Buchholz T.A., Hoffman K.E. : Therapeutic radiation dose delivered to the low axilla during whole breast radiation therapy in the prone position: Implications for targeting the undissected axilla. Pract. Radiat. Oncol. 2014; Mar.-Apr. 4 (2), 116-22
Maione L., Vinci V., Caviggioli F., Klinger F., Banzatti B., Catania B., Lisa A., Klinger M. :
Autologous fat graft in postmastectomy pain syndrome following breast conservative surgery and radiotherapy. Aesthetic Plast. Surg. 2014; Jun. 38 (3), 528-32
Mamounas E.P., Tang G., Liu Q. : The importance of systemic therapy in minimizing local recurrence after breast-conserving surgery: The NSABP experience. J. Surg. Oncol. 2014; Jul. 110 (1), 45-50
Markićević M., Džodić R., Buta M., Kanjer K., Mandušić V., Nešković-Konstantinović Z., Nikolić-Vukosavljević D. : Trefoil Factor 1 in Early Breast Carcinoma: A Potential Indicator of Clinical Outcome during the First 3 Years of Follow-Up. Int. J. Med. Sci. 2014; May 11 (7), 663-73
Mátrai Z., Polgár C., Kovács E., Bartal A., Rubovszky G., Gulyás G. : Special aspects of breast cancer surgery in the elderly. Orv. Hetil. 2014; Jun. 1; 155 (24), 931-8
Medina-Franco H., Rojas-García P., Suárez-Bobadilla Y.L., Sánchez-Ramón A. : Factors associated with breast symmetry after breast conserving surgery for cancer. Rev. Invest. Clin. 2013; Sep.-Oct. 65 (5), 379-83
Menke C.H., Pohlmann P.R., Backes A., Cericatto R., Oliveira M., Bittelbrunn A., Schwartsmann G. : Tumor size as a surrogate end point for the detection of early breast cancer: a 30-year (1972-2002), single-center experience in southern Brazil. Breast J. 2007; Sep.-Oct. 13 (5), 448-56.
Murthy V., Chamberlain R.S. : Nipple-sparing mastectomy in modern breast practice. Clin. Anat. 2013; Jan. 26 (1), 56-65
Nakanishi C., Toi M., Saji S., Bando H. : Current indications for mastectomy in patients with breast cancer. Nihon Geka Gakkai Zasshi 2002; Nov. 103 (11), 821-4
Nowikiewicz T., Srutek E., Jankowski M., Las-Jankowska M., Klag M., Kozak D., Glowacka I., Zegarski W. : Management and results of treatment of breast cancer patients having sentinel lymph node micrometastases. Neoplasma 2014; 61 (3), 299-304.
Ohsumi S., Shimozuma K., Kuroi K., Ono M., Imai H. : Quality of life of breast cancer patients and types of surgery for breast cancer - current status and unresolved issues. Breast Cancer 2007; 14 (1), 66-73
Recchia F., Candeloro G., Cesta A., DI Staso M., Bonfili P., Gravina G.L., Di Cesare E., Necozione S., Rea S. : Anthracycline-based induction chemotherapy followed by concurrent cyclophosphamide, methotrexate and 5-fluorouracil and radiation therapy in surgically resected axillary node-positive breast cancer. Mol. Clin. Oncol. 2014; May 2 (3), 473-478
Rocco G., Mori S., Fazioli F., La Rocca A., Martucci N., Setola S. : The use of biomaterials for chest wall reconstruction 30 years after radical surgery and radiation. Ann. Thorac. Surg. 2012; Oct. 94 (4), 109-10
Sakorafas G.H. : The origins of radical mastectomy. AORN J. 2008; Oct. 88 (4), 605-8
Sharma M.M., Chauhan A. : Oncoplastic breast surgery: Initial experience in an Oncology Center. Med. J. Armed Forces India 2014; Apr. 70 (2), 175-8
Sinn P., Aulmann S., Wirtz R., Schott S., Marmé F., Varga Z., Lebeau A., Kreipe H., Schneeweiss A. : Multigene Assays for Classification, Prognosis, and Prediction in Breast Cancer: a Critical Review on the Background and Clinical Utility. Geburtshilfe Frauenheilkd. 2013; Sep. 73 (9), 932-940.
Sung J.S., Li J., Costa G.D., Patil S., Van Zee K.J., Dershaw D.D., Morris E.A. : Pre-operative breast MRI for early-stage breast cancer: effect on surgical and long-term outcomes.
AJR Am. J. Roentgenol. 2014; Jun. 20 (6), 1376-82
Tashima Y., Kawano K. : A case of local recurrence developing thirty-nine years after mastectomy for breast cancer. Gan To Kagaku Ryoho 2014; Mar. 41 (3), 357-9.
Tazhibi M., Sarrafzadeh S., Mokarian F., Babazade S., Tabatabaeian M., Rezaei P., Faghihi M., Taleghani F. : Comparison of satisfactions from mastectomy and lumpectomy in breast cancer patients. J. Educ. Health Promot. 2014; Feb. 21, 3:22
Teh Y.C., Shaari N.E., Taib N.A., Ng C.H., See M.H., Tan G.H., Jamaris S., Yip C.H. :
Determinants of choice of surgery in asian patients with early breast cancer in a middle income country. Asian Pac. J. Cancer Prev. 2014; 15 (7), 3163-7.
Teshome M., Hunt K.K. : Neoadjuvant Therapy in the Treatment of Breast Cancer. Surg. Oncol. Clin. N. Am. 2014; Jul. 23 (3), 505-523
Veronesi U., Cascinelli N., Mariani L., Greco M., Saccozzi R., Luini A., Aguilar M., Marubini E. : Twenty-year follow-up of a randomized study comparing breast-conserving surgery with radical mastectomy for early breast cancer. N. Engl. J. Med. 2002; Oct. 347 (16), 1227-32.
Vila J., Garcia-Etienne C.A., Vavassori A., Gentilini O. : Conservative surgery for ipsilateral breast tumor recurrence. J. Surg. Oncol. 2014; Jul. 110 (1), 62-7
von Smitten K. : Surgical management of breast cancer in the future. Acta Oncol. 2000; 39 (3), 437-9
Zahir M.N., Minhas K., Shabbir-Moosajee M. : Pleomorphic lobular carcinoma of the male breast with axillary lymph node involvement: a case report and review of literature. BMC Clin. Pathol. 2014; Apr. 27, 14-16
Zhang B.N., Zhang B., Tang Z.H., Xie X.M., Yang H.J., He J.J., Li H., Li J.Y., Li J., Fan J.H., Huang R., Song Q.K., Zhang H.M., Qiao Y.L. : 10-year changes and development of surgical treatment for breast cancer in China. Zhonghua Zhong Liu Za Zhi 2012; Aug. 34 (8), 582-7
Zhang B., Song Q., Zhang B., Tang Z., Xie X., Yang H., He J., Li H., Li J., Li J., Fan J., Huang R., Zhang H., Qiao Y. : A 10-year (1999 ~ 2008) retrospective multi-center study of breast cancer surgical management in various geographic areas of China. Breast 2013; Oct. 22 (5), 676-81
Zurrida S., Costa A., Luini A., Galimberti V., Sacchini V., Intra M. : The Veronesi quadrantectomy: an established procedure for the conservative treatment of early breast cancer.
Int. J. Surg. Investig. 2001; 2 (6), 423-31




